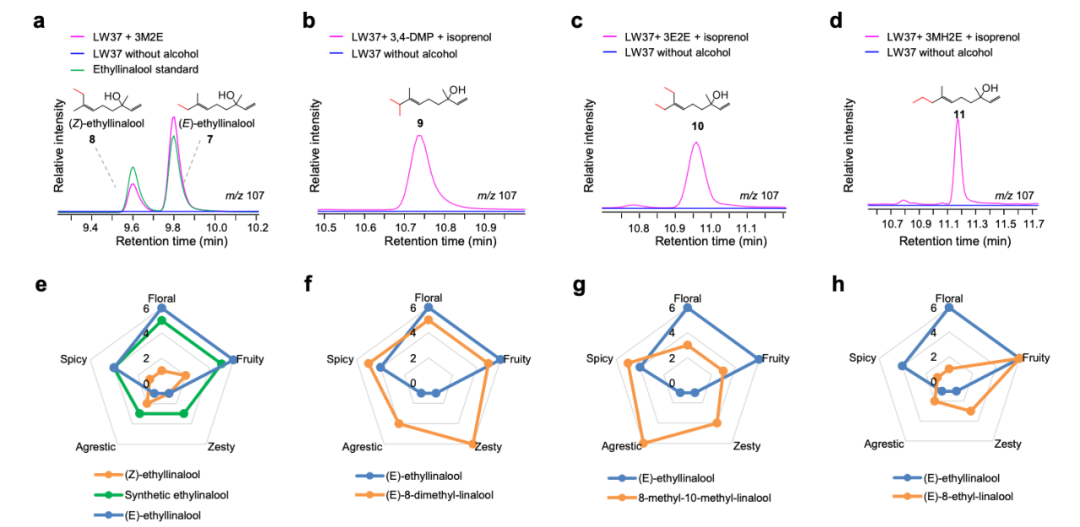
在走出隐匿模式 5 个月后,由 DeepMind 前员工 Simon Kohl 创办的 AI 蛋白质设计公司 Latent Labs 宣布推出该公司的首个 AI 模型 Latent-X,称其可以通过浏览器一键式设计蛋白质结合物。
也就是说,用户只需提供靶点蛋白序列、结构及热点残基位置,并在网页上点击一下,即可引导模型生成针对特定蛋白表位的指定类型结合剂。报告称每个靶点只需测试 30 个候选药物,即可实现通常需要测试数百万个候选药物才能实现的目标。
首席执行官兼创始人 Simon Kohl 表示:“我们憧憬这样一个未来,有效疗法可以完全通过计算机设计,就像当今设计航天任务或半导体一样。我们的平台让科学家无论是否具备 AI 专业知识,都能轻松获得经实验室验证的蛋白质结合剂设计方案,无需任何 AI 基础设施。这是实现‘生物学可编程化’使命的第一步,最终让药物设计变得即时可得。”
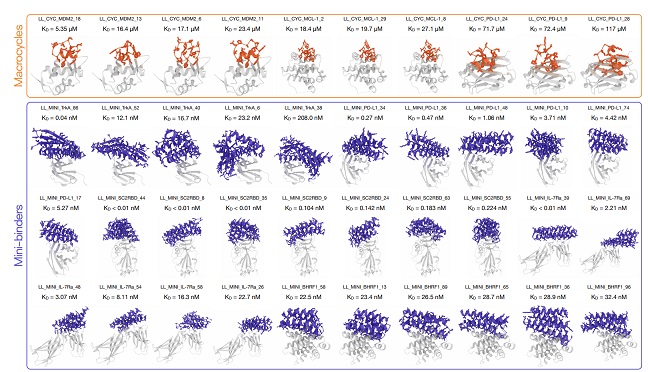
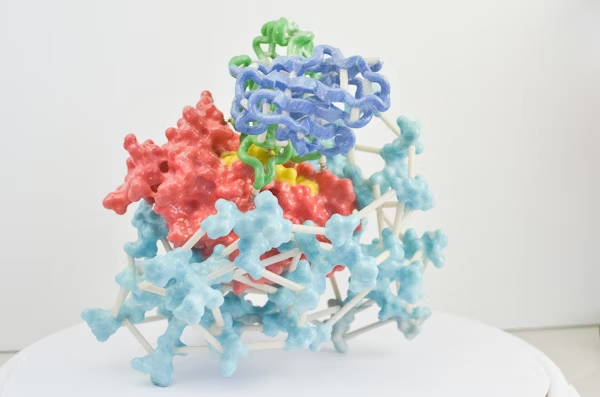
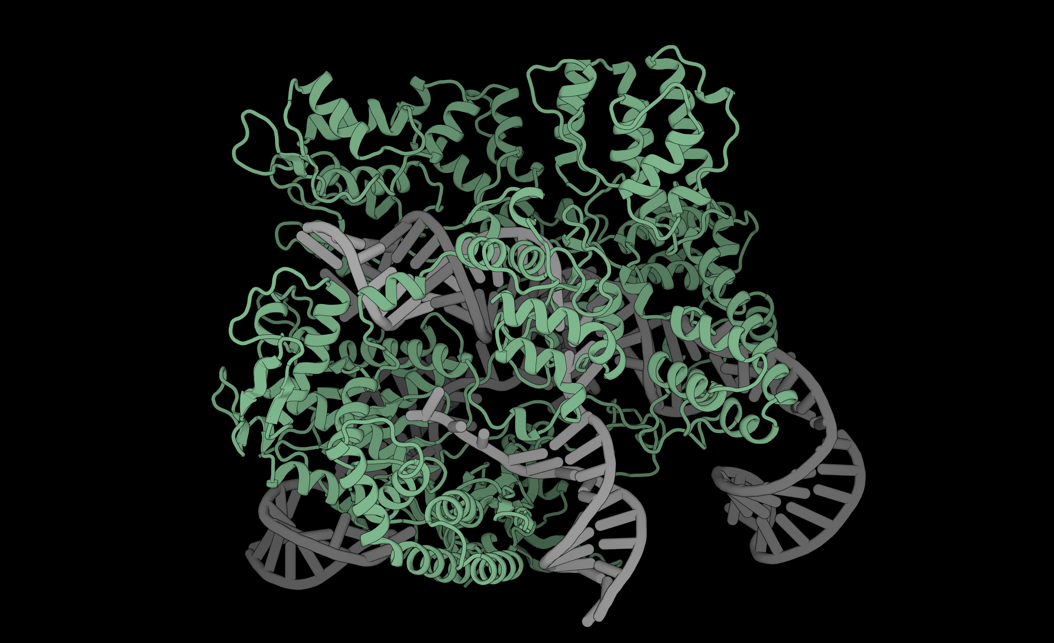
图 | Latent-X 仅需针对每个靶点测试 30-100 个候选分子,即可生成具有高亲和力的全原子蛋白质结合物
目前,该模型已在 Latent 的无代码人工智能蛋白质设计平台上开放抢先体验,用户可以上传蛋白质靶标,直接在浏览器中生成环肽和微型结合物。通过该平台,用户在生成结合物后,可以选出排名靠前的结构进行进一步的实验室测试。
大环肽作为小型环状肽,其环化结构在保持特异性的同时增强抗降解能力,兼具生物利用度和组织渗透性;微型结合剂则是具有任意折叠结构的短蛋白,能以灵活形式实现高亲和力与高特异性,成为靶向递送、诊断和治疗性抑制剂的新兴治疗类别。
在一篇题为“Latent-X: An Atom-level Frontier Model for De Novo Protein Binder Design”的报告中,研究团队详细介绍了 Latent-X 模型。
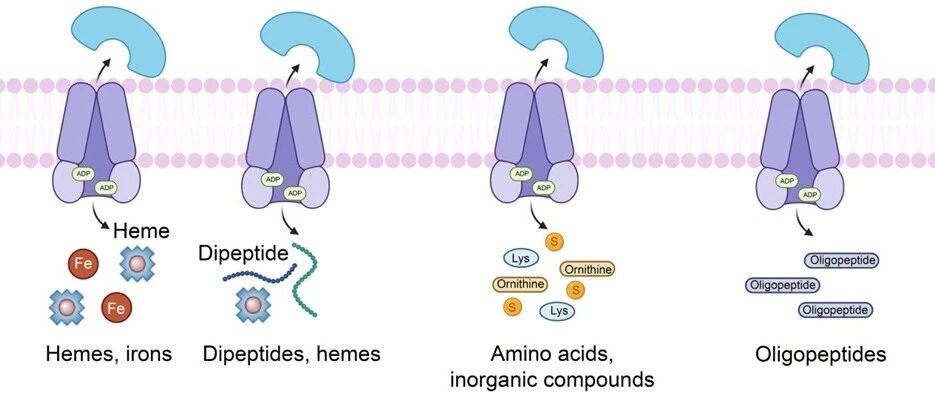
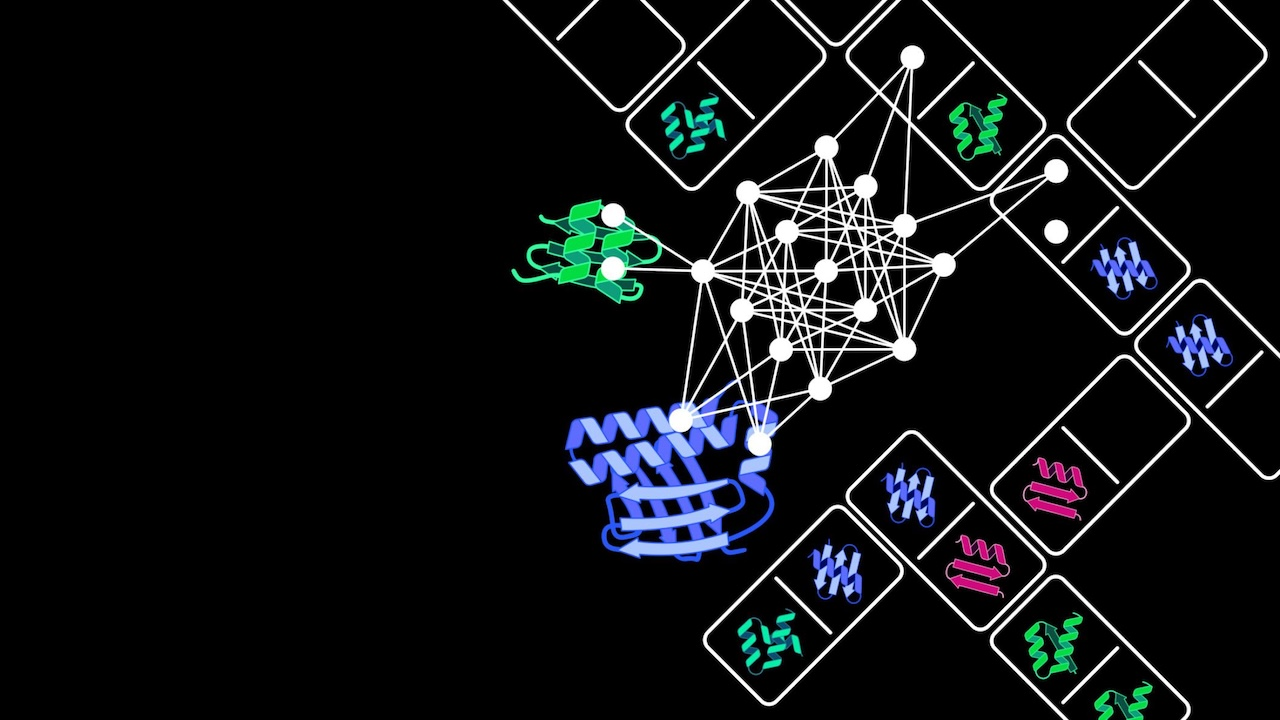
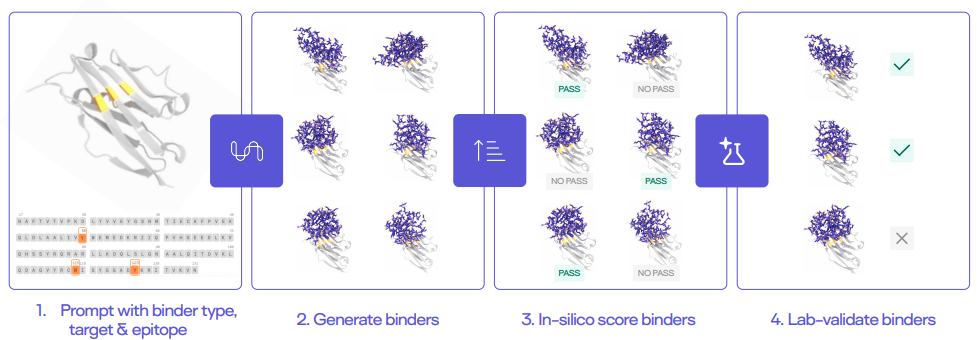 图 | Latent-X 模型设计蛋白质流程
图 | Latent-X 模型设计蛋白质流程
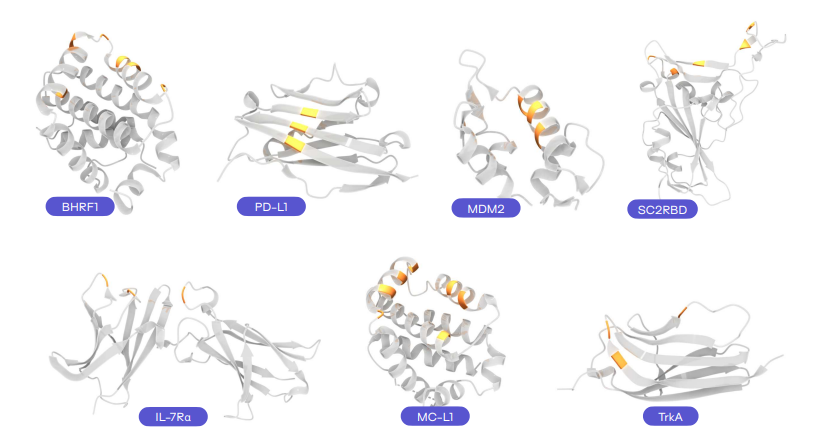
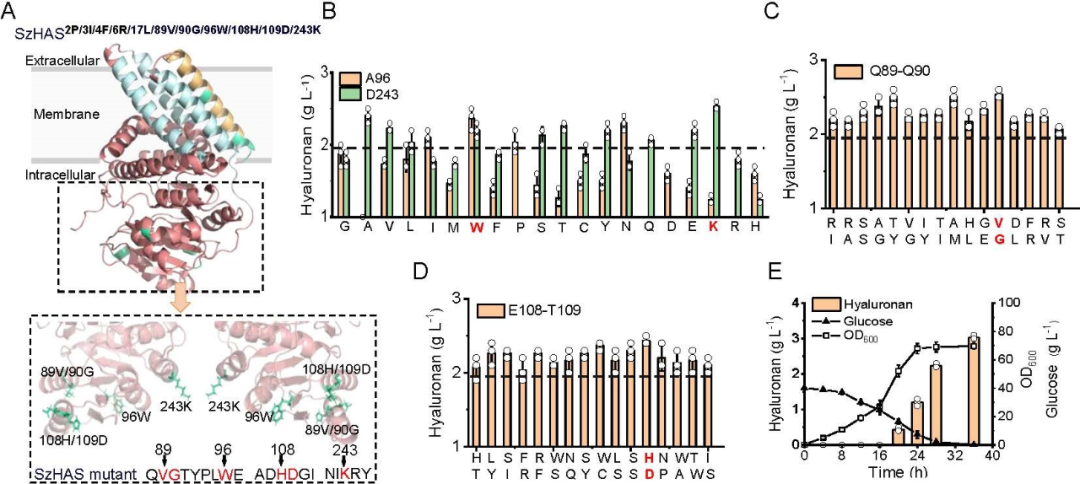
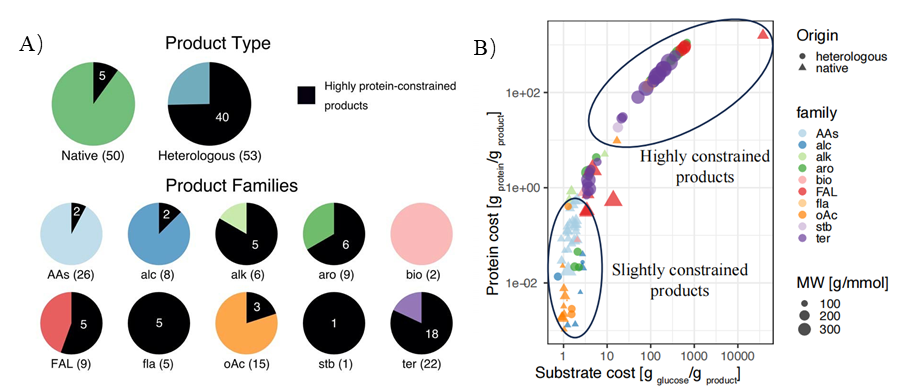
为验证 Latent-X 的性能,团队选取了 7 种基准靶点蛋白进行大环肽和微型结合剂的实验测试。这些靶点曾被用于评估当前最先进的生成设计方法 RFdiffusion、RFpeptides 和 AlphaProteo 等。
所选基准靶点覆盖病毒感染、免疫调节、癌症和神经病理等多个治疗领域,其结合难度各异。包括:BHRF1,EB 病毒的抗凋亡蛋白,通过模拟 Bcl-2 蛋白抑制宿主细胞凋亡;SC2RBD,SARS-CoV-2 刺突蛋白受体结合域,靶向该区域可阻断病毒入侵;MDM2,p53 肿瘤抑制因子的负调控因子,在癌症中常过表达;MCL-1,Bcl-2 家族抗凋亡成员,促进癌细胞存活;PD-L1,免疫检查点蛋白,其平坦的极性界面使传统抗体难以靶向;IL-7Rα,淋巴细胞发育关键受体,与自身免疫病和白血病相关;TrkA,参与神经生长与疼痛的受体,其浅层疏水结合口袋是设计难点。
在针对 7 个治疗靶点的广泛湿实验室实验中,Latent-X 的大环化合物命中率为 91% 至 100%,而微型结合物的命中率为 10% 至 63%。该模型对微型结合物的结合亲和力达到皮摩尔级,与已获批疗法相当,对大环肽的结合亲和力达到微摩尔级,且生成的结合物表现出极强的靶点特异性。
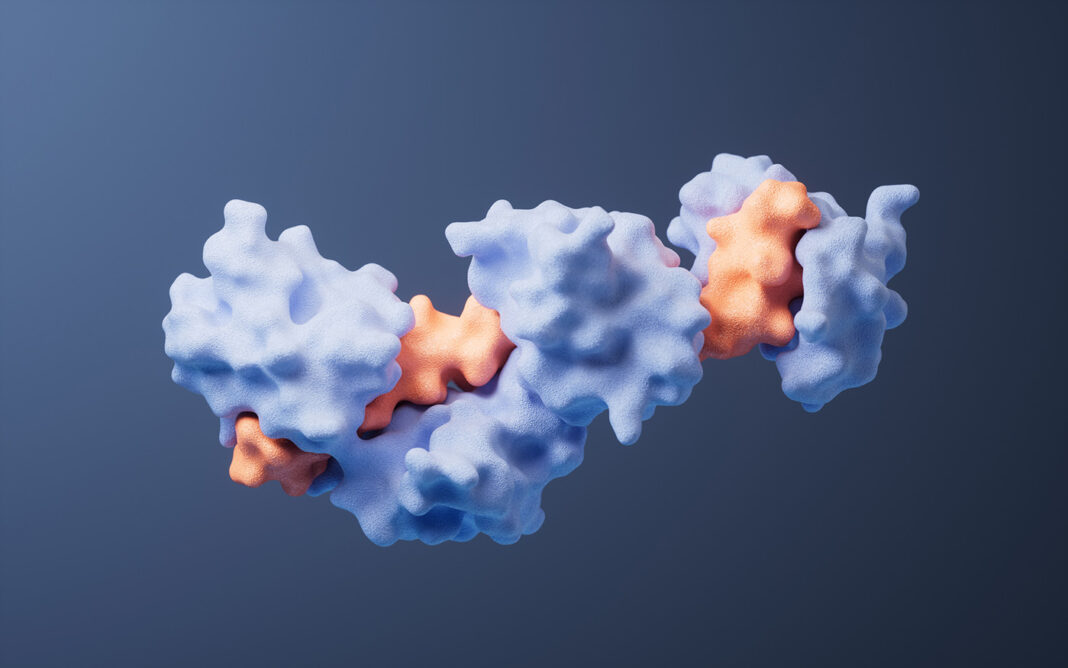
该模型通过协同生成结合剂与靶点的全原子结构,能精准构建决定结合生物化学特性的侧链相互作用。Latent-X 可在结合界面形成包括复杂氢键网络在内的高特异性相互作用。通过靶点协同设计,模型既能保持未结合靶点骨架结构的高保真度,又可灵活调整靶点侧链构象与柔性环区结构。
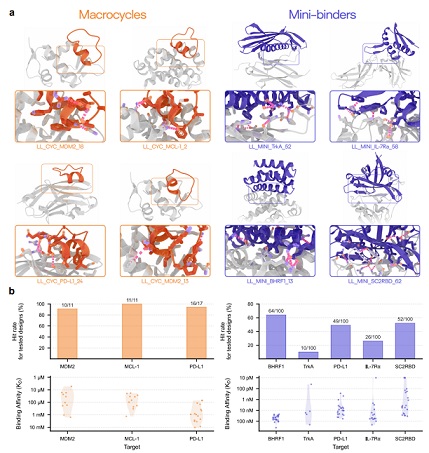
图 | Latent-X 可生成高命中率与结合亲和力的全原子结合物
在不需重新训练或微调的情况下,该模型通过生成大环肽与微型结合剂展现了多拓扑结构的泛化能力:微型结合剂保留自然界常见的开放末端,而大环肽通过末端融合形成环状拓扑。除拓扑多样性外,Latent-X 还能生成包含复杂 β-折叠等结构基元的功能性结合剂。这种结构多样性对于靶向各类蛋白表面及实现特异性结合至关重要,而既往成功的微型结合剂主要局限于 α-螺旋束结构。
该模型的生成速度比以往方法快 10 倍以上,并可同时对序列和结构进行共采样,从而能够在几秒钟内完成计算实验。该公司目前正寻求合作伙伴,将这些扩展的能力应用于新的药物应用。
报告中也提到了当前模型的局限性,部分设计存在与天然蛋白的序列相似性,影响设计新颖性;依赖靶标结构信息的特性限制了在未知结构靶点中的应用;512 个氨基酸的上下文窗口虽满足常规需求,但可能制约超大结合剂设计;现有计算机筛选器基于 45-65 个氨基酸的螺旋结构微型结合剂优化,在长链和非螺旋结构中可能出现假阳性/阴性偏差,需扩展训练数据以覆盖更丰富的结构基序和长度范围。
未来研究方向包括拓展大环肽和微型结合剂之外的其他结合剂模式可展示更广泛的应用性;开发多靶点结合剂或具有设计特异性谱的结合剂方法,能够实现更复杂的治疗应用;将稳定性、表达水平和药代动力学特性等更多生化约束直接整合到生成过程中,产生更具药物特性的设计。
展望未来,AI 驱动的蛋白质设计方法将持续变革治疗开发范式。随着技术成熟度提升及适用场景扩展(涵盖更多药物模态和生化约束),该技术有望实现“按需定制”蛋白质药物的常规化生产,为推进可预测、高效率、广谱可及的蛋白质药物开发奠定了坚实基础。
值得注意的是,五个月前,Latent Labs 宣布完成 5000 万美元融资,由 Radical Ventures 和 Sofinnova Partners 联合领投,谷歌首席科学家 Jeff Dean、Anthropic 首席执行官 Dario Amodei 和 Eleven Labs 首席执行官 Mati Staniszewski 也参与其中。团队成员包括前 AlphaFold2 联合开发者、前 DeepMind 团队负责人,并拥有来自微软、苹果、Stability AI、Exscientia、Mammoth Bio、Altos Labs 和 Zymergen 的团队成员。
参考链接:
1.https://www.latentlabs.com/wp-content/uploads/2025/07/Latent-X-Technical-Report.pdf
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。
























































































































































































安各洛(深圳)生物科技有限公司 版权所有