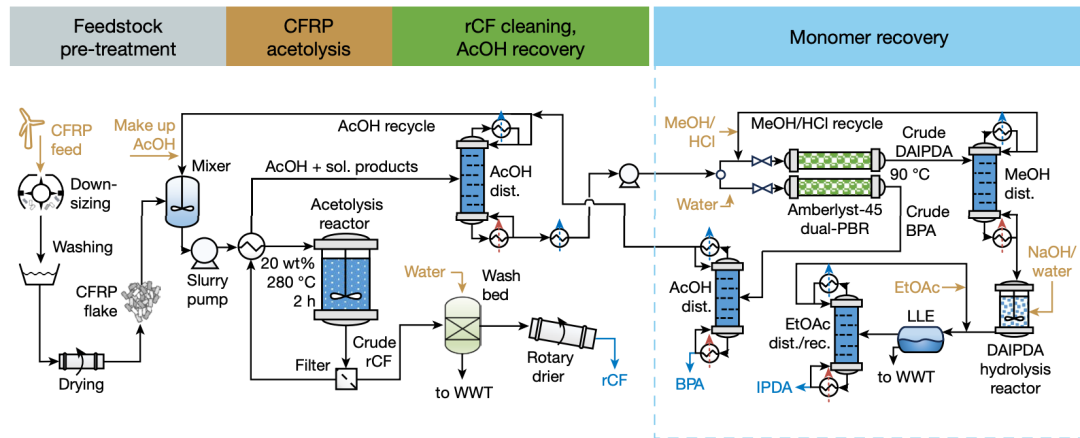
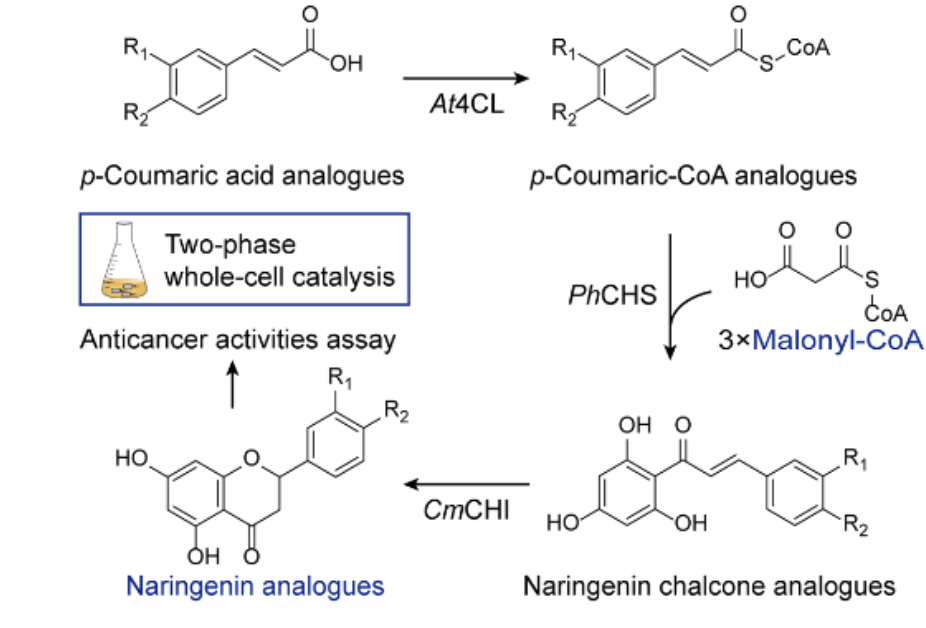
在过去的几十年里,许多致病菌对现有抗生素的耐药性越来越强,而开发出的新抗生素却很少。鲍曼不动杆菌是一种常见于医院感染的革兰氏阴性病原体,通常会引起菌血症、肺炎、脑膜炎、腹膜炎、心内膜炎以及泌尿道和皮肤感染。由于其坚固的外膜以及获取和留存胞外DNA的能力,鲍曼不动杆菌往往表现出多重耐药性。此外,它可以在物体表面上存活很长时间,并且能够耐受干燥。用传统的筛选方法寻找针对鲍曼不动杆菌的新型抗生素具有很强的挑战性。
为了解决上述问题,来自麦克马斯特大学的Gary Liu和麻省理工学院的Denise B. Catacutan研究课题组通过人工智能技术找出了抑制鲍曼不动杆菌的新型抗生素(图1)。机器的深度学习方式可以快速探索化学空间,增加发现新型抗菌分子的可能性。研究组筛选了大约7500种分子,进而构建模型,对具有抗鲍曼不动杆菌活性的新分子结构进行了硅质预测,最终找到了一种名为Abaucin的抗生素,其能够有效抑制鲍曼不动杆菌。此研究发表于权威期刊《Nature chemical biology》,题目为“Deep learning-guided discovery of an antibiotic targeting Acinetobacter baumannii”。
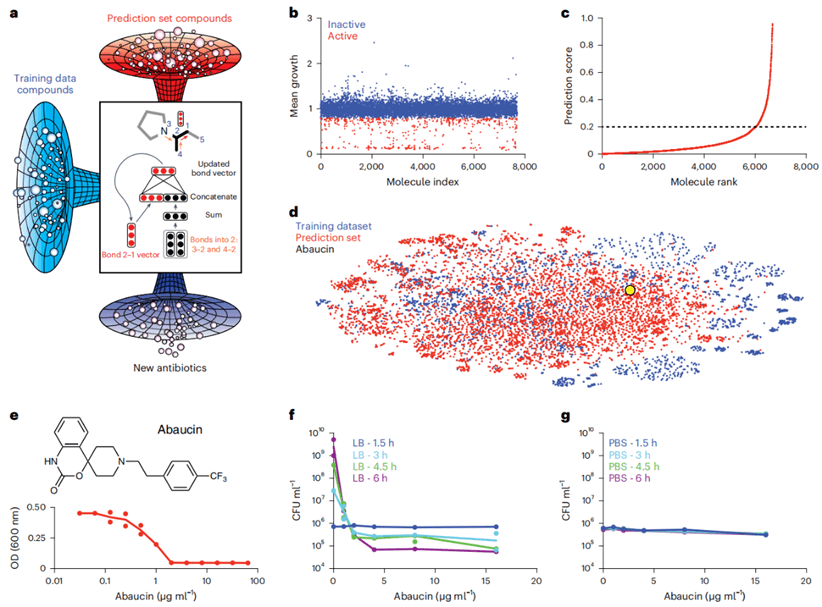
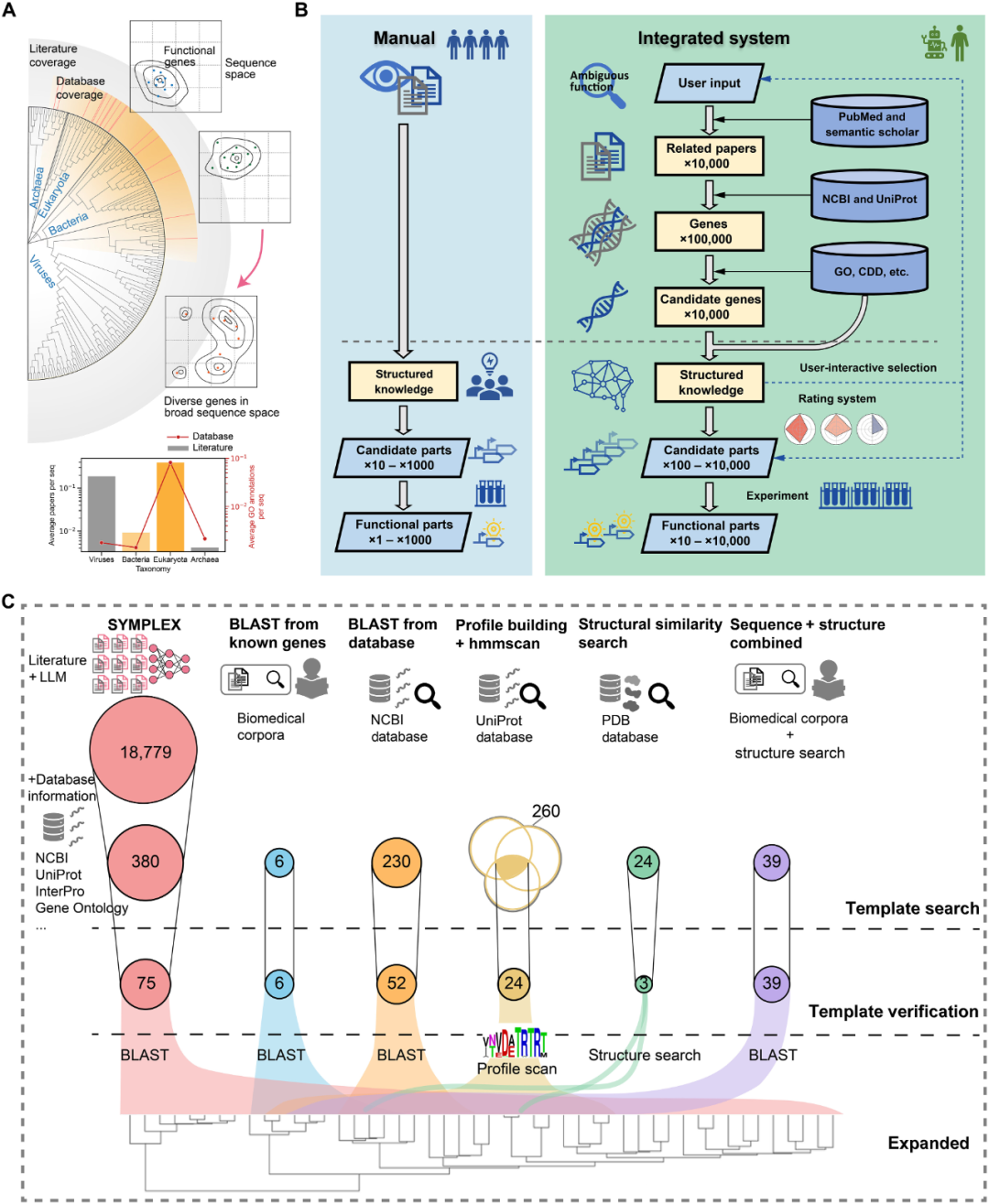
图 1机器学习引导发现Abaucin
首先,研究组为得到数据集,对7,684种小分子进行了筛选,以50 µM的浓度检测其对鲍曼不动杆菌ATCC 17978在LB培养基中的生长抑制作用。根据传统的命中率分界线,他们得到了480个“活性”分子,7,204个“非活性”分子。接下来,该数据集被用来训练一个二元分类器,以预测新分子结构能否显示出对鲍曼不动杆菌的活性。研究组将分子表征与使用RDCit计算的固定分子特征相结合来增强模型结构。为了进一步提高模型的性能,研究组通过使用十个分类器的集合,对7,684个分子的训练数据集进行模型建立和训练。对模型进行训练后,研究组将其应用于药物再利用库更新后的6,680种分子中,以识别对鲍曼不动杆菌具有活性的抗菌分子,进而确定了240个优先分子进行实验测试。实验测试产生了9种候选抗生素,进一步评估后发现RS102895(后被重新命名为Abaucin)在抑制鲍曼不动杆菌生长方面效果明显更强。
其次,通过在低于和高于最低抑菌浓度的范围内测试Abaucin,研究组观察到Abaucin可以克服多样性临床菌株库中鲍曼不动杆菌分离物的所有内在和获得性耐药机制。进一步研究Abaucin所显示的谱活性,发现Abaucin对铜绿假单胞菌、金黄色葡萄球菌和耐碳青霉烯肠杆菌没有显示出任何生长抑制活性,这说明Abaucin具有“窄谱”抗菌活性,有利于减少耐药性在不同病原体间的传播,并且这种抗生素在使用过程中可能不会伤害生活在人体肠道中的有益细菌,减少并发症出现几率。
再次,为了阐明Abaucin“窄谱”功能机制,研究组用含有不同浓度Abaucin的固体培养基选出Abaucin耐药突变体,再对四个独立的耐药株进行全基因组测序,发现了LolE基因中或上游的突变。LolE是一种内膜蛋白质,参与脂蛋白转运,对新型革兰氏阴性抗生素开发十分重要。突变数据和体外结构的观察表明Abaucin会抑制鲍曼不动杆菌中LolE介导的脂蛋白调节和运输。
最后,为了测试Abaucin的体内疗效,研究组对C57BL/6小鼠进行了预处理,使其中性粒细胞减少,并在小鼠背部表面使用鲍曼不动杆菌ATCC 17978 (~6.5×106 CFU接种量)建立了一个创伤感染模型,允许细菌种群在1小时内扩大。在小鼠感染后的2小时、3小时、4小时、6小时、10小时、21小时和24小时,分别用含有载剂(1.65% DMSO)或Abaucin(4% 重量/体积)的Glaxal Base润肤霜进行治疗。在接受载剂治疗的小鼠中,研究组在实验终点得到的细菌负荷约为6.9×108 CFU/g,并观察到受伤组织明显发炎;而接受Abaucin治疗的小鼠细菌负荷约为4.0×107 CFU/g,并且Abaucin治疗的组织显示出明显较少的炎症。结果表明Abaucin可以有效抑制鲍曼不动杆菌的创伤感染。
综上所述,研究人员在人工智能的帮助下发现了一种名为 Abaucin 的抗菌化合物,它具有针对鲍曼不动杆菌的“窄谱”活性,能够通过干扰 LolE 的机制来干扰类脂蛋白的转运过程,并且Abaucin 能够有效控制鲍曼不动杆菌感染。这项研究体现了机器学习在发现新抗生素方面的作用,为具有挑战性的革兰氏阴性病原体研究提供了方向。在未来的研究中,可以通过增加鲍曼不动杆菌抗生素训练数据集的规模,对更大的体外化学库进行预测,来进一步扩展这项研究工作。此外,研究人员还可以应用多性能优化模型,同时预测多种研究对象的性质,例如某种病原体的生长抑制情况以及哺乳动物细胞的毒性等。
























































































安各洛(深圳)生物科技有限公司 版权所有