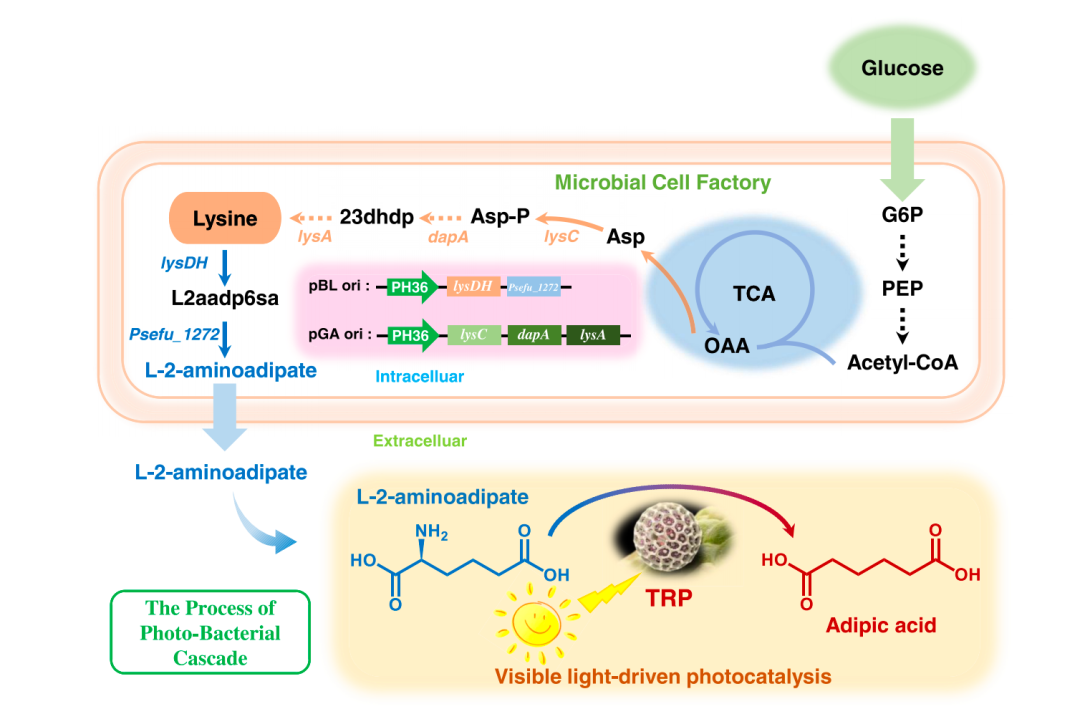
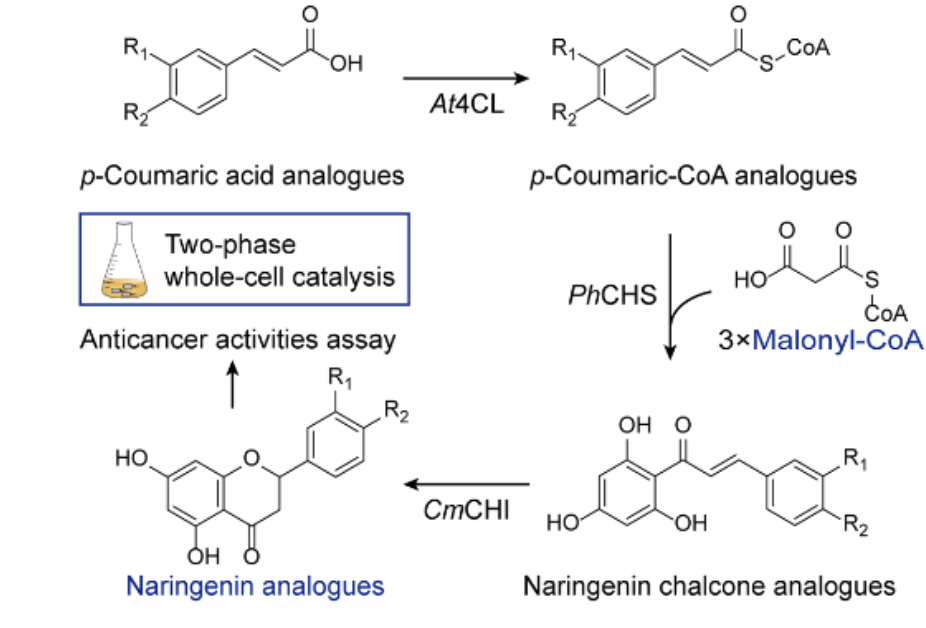
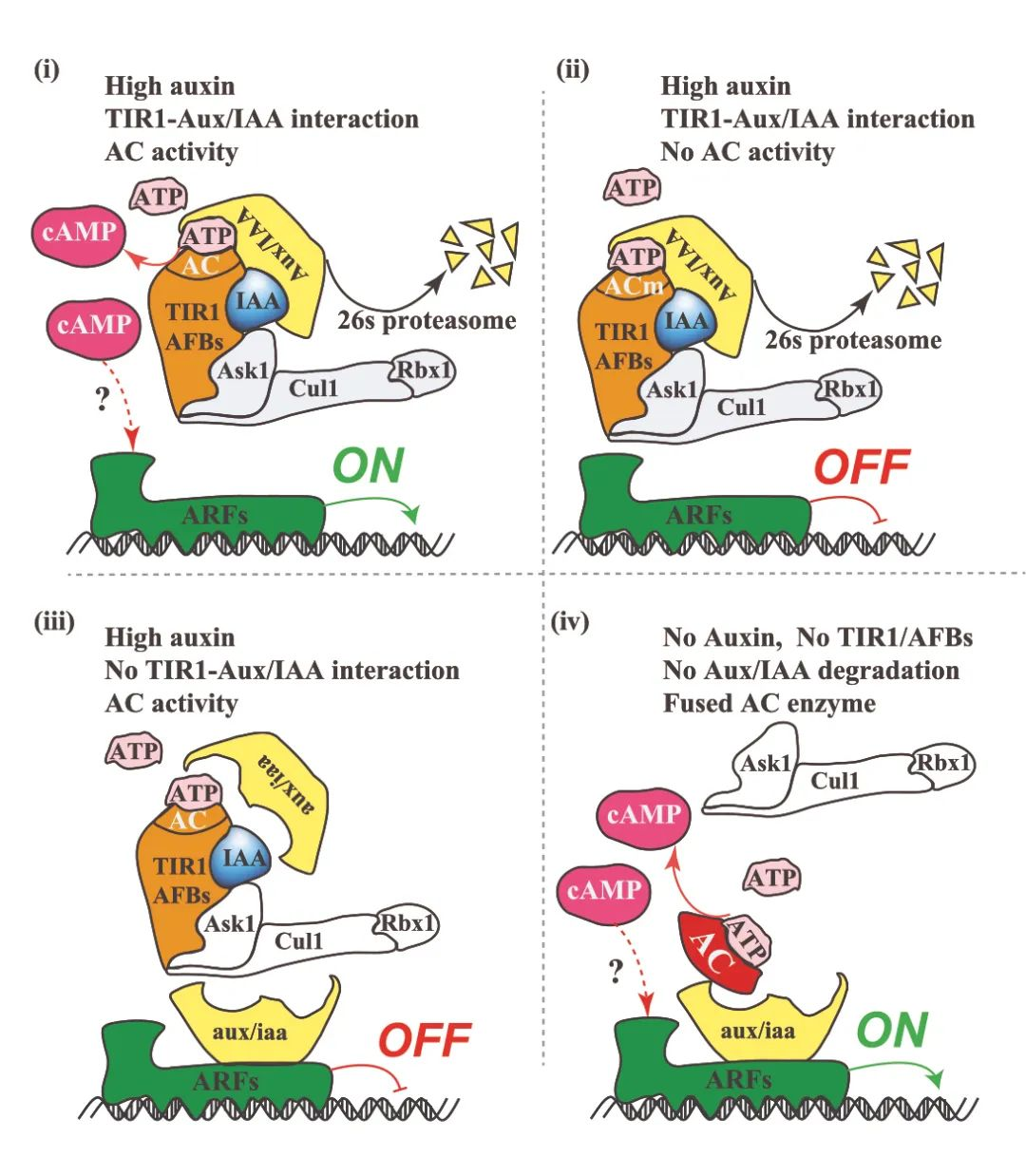
抗生素耐药性被世界卫生组织列为“全球公共卫生的十大威胁”之一。随着传统抗生素逐渐失去效力,细菌感染的临床治疗正面临前所未有的挑战。
传统的抗生素研发依赖于大规模化合物筛选或天然产物挖掘。一个新药从发现到上市往往需要 10 年以上、投入数十亿美元,而成功率不足 5%。与此同时,细菌进化出越来越复杂的耐药机制,使得传统研发模式难以为继,然而,人工智能为解决这一难题带来了新的可能。
近期,美国麻省理工学院(MIT)、哈佛大学等多家高校的研究团队合作,在 Cell 期刊发表了一篇题为“A generative deep learning approach to de novo antibiotic design”的成果,研究人员利用生成式人工智能成功设计并验证了一类全新的抗菌化合物。这些化合物不仅能有效杀死多种耐药细菌,如耐药淋病奈瑟菌和耐多药金黄色葡萄球菌(MRSA),还展现出良好的选择性和安全性。
研究人员利用生成式人工智能设计了超过 3600 万种可能的化合物,并通过计算筛选了它们的抗菌特性。其中,最热门的候选化合物在结构上与现有抗生素截然不同,它们似乎采用了破坏细菌细胞膜的新机制。
这项研究建立在麻省理工学院 James Collins 等人主导的“抗生素-人工智能项目”已取得的进展基础上。这项工作已经发现了几种有前景的候选药物,包括 halicin 和 abaucin。
在此次研究中,Collins 及其合作者不再局限于搜索现有化合物库,而是进一步生成假设可能存在但尚未被发现或合成的分子。
具体而言,他们采用了两种不同方法:定向生成:指导算法基于已知具有抗菌活性的特定化学片段设计分子;自由生成:允许算法无需依赖特定片段,自由生成全新分子结构。
研究团队首先采用片段定向生成法,筛选可能杀灭淋病奈瑟菌(导致淋病的病原体)的分子。其第一步是构建一个包含约 4500 万个已知化学片段的库,这些片段由碳、氮、氧、氟、氯和硫的 11 原子组合构成,并整合了 Enamine 公司 REAL Space 化合物库中的片段。
随后,他们利用经训练的机器学习模型对该分子库进行筛选,以预测针对目标细菌的抗菌活性,近 400 万个片段脱颖而出。研究人员通过排除以下三类片段进一步缩小范围:对人类细胞有潜在毒性的片段;存在化学不稳定性风险的片段;与现有抗生素结构相似的片段。
最终保留约 100 万种化合物。经过后续实验与计算分析,团队锁定了一个代号为 F1 的片段,其对淋病奈瑟菌展现出显著活性。
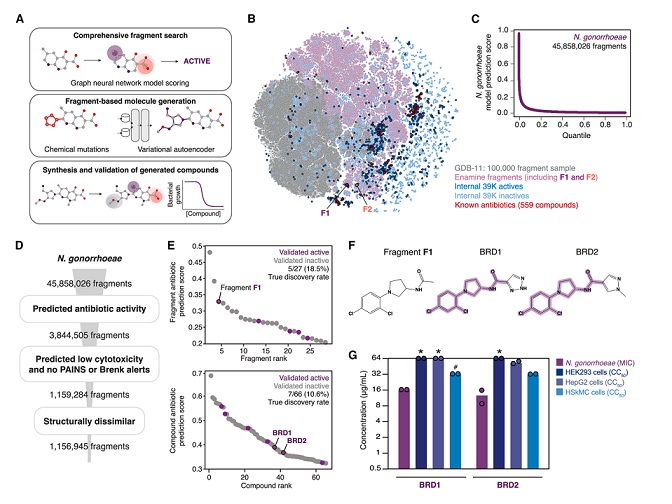
图 | 获得具有潜在抗菌活性的化学片段 F1
以此片段为基础,他们采用两种生成式 AI 算法设计新化合物:CReM 算法:以含 F1 的分子为起点,通过原子或化学基团的增删替换生成新分子;F-VAE 算法:通过学习片段常见修饰模式,将 F1 扩展为完整分子。
为确保候选分子的质量,研究团队还建立了严格的多维度筛选标准,包括抗菌活性预测分数需大于 0.7、合成难度评分低于 3、与已知抗生素相似度小于 0.5 以及细胞毒性风险低于 0.2 等。
两种算法共生成 700 万个含 F1 的候选分子,经计算筛选后保留约 1000 种。科学家从中选择 80 种进行合成,最终仅成功合成两种,其中代号 NG1 的分子在细胞和小鼠耐药淋病模型中均能有效杀灭淋病奈瑟菌。
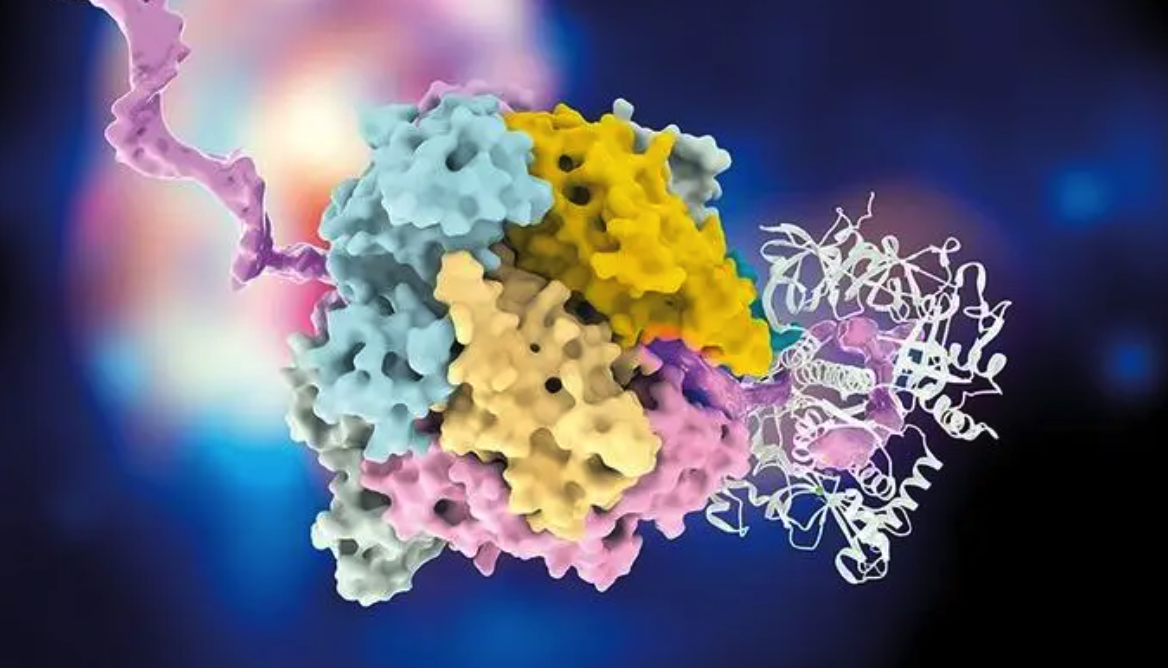
深入研究显示,NG1 通过与细菌外膜合成关键蛋白 LptA(全新药物靶点)相互作用,干扰膜合成进而致死细菌。在小鼠阴道感染模型中,NG1 治疗组的细菌载量降低了近 3 个数量级。
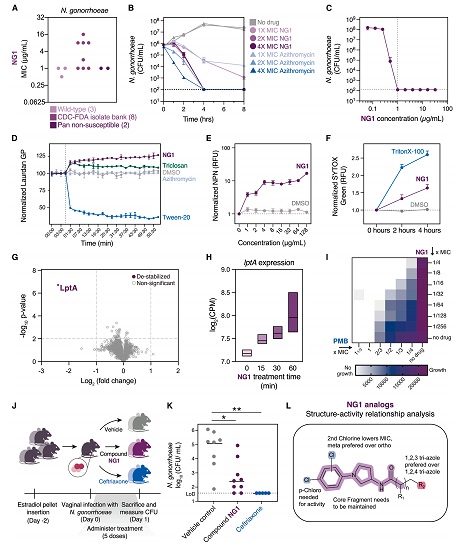
图 | 先导化合物 NG1 的作用机制,及在小鼠感染模型中的治疗效果评估
在另一组实验中,团队采用自由生成法设计靶向耐药金黄色葡萄球菌的新分子。使用相同算法,但仅保留原子组合的基本化学规则,通过 CReM 和 VAE 算法,最终生成 2900 万种化合物。经筛选后聚焦约 90 种,成功合成并测试其中 22 种。
结果显示,6 种分子在体外对 MRSA 表现出强大抗菌活性,其中,最优候选分子 DN1 对包括 MRSA 在内的金黄色葡萄球菌临床分离株展现出了强大的广谱杀菌活性,其通过干扰细菌膜电位发挥快速杀菌作用,且自发突变频率极低,在小鼠皮肤感染模型中,DN1 的疗效与临床常用药物夫西地酸相当。与 NG1 类似,DN1 同样通过破坏细菌细胞膜发挥作用,但作用机制不依赖特定蛋白。
非营利组织 Phare Bio 正对 NG1 和 DN1 进行结构优化以推进后续试验。Collins 表示,下一步将挑战结核分枝杆菌和铜绿假单胞菌等耐药病原体。
这一研究的成功不仅展示了生成式 AI 在药物发现中的潜力,也体现了人工智能与传统药物化学的协同优势。AI 可以在庞大的化学空间中生成和筛选数百万种理论分子,大幅提升了药物发现效率;而药物化学家则根据实验和计算结果优化候选分子,使其具备可合成性和安全性。
此次研究是又一次重大飞跃,生成式 AI 在抗菌药物设计上的突破,为解决抗菌耐药提供了真正的新方向。它不仅大大缩短了研发周期,也拓展了可能的化学结构空间,为新型抗菌药物的研发以及为解决耐药危机提供了前沿工具。
参考文献:
1. https://www.cell.com/cell/abstract/S0092-8674(25)00855-4
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有