在与肠道病原体的博弈中,人类正在重新思考“战斗方式”。传统的抗生素策略往往将目标锁定在杀死病菌上,但对于一些病原体而言,这种激烈手段反而会引发更严重的后果。例如志贺毒素(Shiga toxin),一种由致病性大肠杆菌和志贺菌产生的毒素,其致死性高,临床上可引发溶血性尿毒综合征(HUS)等严重后果。然而,由于抗生素可诱发细菌 SOS 反应,促使毒素释放加剧,因此往往被禁止使用。眼下,治疗志贺毒素相关感染的手段极为有限。
哥伦比亚大学的 Harris Wang 团队近期在 Nature Biomedical Engineering 发表题为“Precise virulence inactivation using a CRISPR-associated transposase for combating Enterobacteriaceae gut pathogens”的论文,提出了令人眼前一亮的策略:不再杀菌,而是通过 CRISPR-转座酶系统精准“灭毒”,将致病菌重编程为低毒甚至无害的存在。这一系统被命名为“BACTRINS”(Bacterial CRISPR-Transposase Reduction of Virulence In Situ),核心思想是,通过细菌之间天然的接合转移机制,把一段设计好的“治疗载体”送进病原体基因组中,从而精准敲除 Shiga 毒素编码基因,同时表达具有抗感染功能的蛋白质,实现治疗与阻断的双重效果。

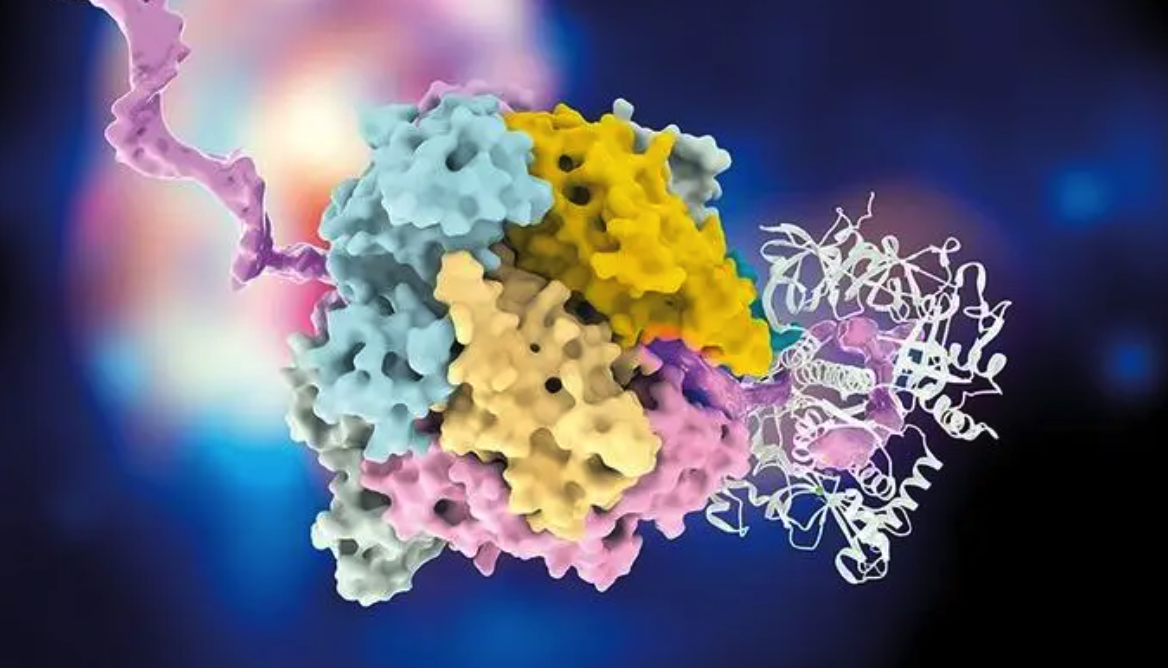
研究团队首先设计了可靶向 Stx1 和 Stx2 毒素基因高度保守区域的 gRNA,并与 Type I-F 类 CRISPR 转座酶系统(CAST)协同运作,实现对目标毒素基因的定点插入干扰。不同于 Cas9 等核酸酶系统,CAST 系统并不切割 DNA 双链,而是通过 RNA 引导的转座作用,将治疗载荷(如纳米抗体基因)精准插入毒素基因内部,实现插入失活。这种方式不仅减少了脱靶风险,还显著降低了细菌产生抗性突变的可能性。实验显示,该系统能在体外以 42–82% 的整合效率精准插入 Stx1A 或 Stx2B 位点,覆盖了多种临床分离的大肠杆菌与志贺菌菌株。更重要的是,即便在厌氧环境下,系统依旧保持约 70% 的整合效率,适应肠道生态。

图 | BACTRINS 系统概览图
为了验证 BACTRINS 系统在真实微生物群体中的功能,研究团队首先进行了体外靶向实验,并随后优化了递送方式。特别是将早期使用的 pGT-B 接合载体更换为更高效的自传导质粒 TP114,使系统的体内递送能力显著增强,接合效率提高了 3 至 7 倍,为后续小鼠模型实验中的高整合率奠定了基础。
团队构建了两种小鼠感染模型:一种是轻度致病的 Sd13313 菌株(仅含Stx1),另一种是高毒性的 Ec43895 菌株(同时含 Stx1 与 Stx2)。在 Sd13313 模型中,单次口服给药后,转移效率在 3 天内接近 100%,5 天内整合效率达到 100%,成功灭活毒素基因,且未观察到动物不良反应,验证了系统的安全性和有效性。
而在致死性更高的 Ec43895 模型中,研究进一步揭示 Stx2 是该菌株致病力的主要来源。将 BACTRINS 系统靶向整合至 Stx2B 位点后,毒素水平下降约 4.6 倍,小鼠完全免于死亡。相比之下,敲除 Stx1A 几乎无保护作用。值得一提的是,这些 Stx2B 失活的 Ec43895 菌株在体内仍能定植但不致病,相当于一种“减毒活疫苗”(live-attenuated vaccine),能够激发宿主对野生毒株的免疫记忆。后续实验显示,经此改造菌株预处理的小鼠在再次感染原始 Ec43895 时表现出完全抵抗力,提示该策略具备长期保护潜力。
为了进一步增强治疗能力,研究团队开发了 BACTRINS 系统的升级版本(v3b),其载体中加入了一段能表达 TD4 纳米抗体的基因模块。该抗体可特异性结合病原体外膜蛋白 Tir,阻断其与肠上皮的黏附行为,从而抑制定植。结果显示,该双功能载体不仅维持了与前版本相当的转移效率,且在 Stx2B 整合率上达到 100%。重要的是,这一策略显著降低了毒素水平,并使 10% 的小鼠在高度致死性挑战中存活超过 15 天,远高于其他组。

图 | BACTRINS v3b 联合纳米抗体的增强疗效
这一结果在治疗策略上具有革命性意义。BACTRINS 平台并不消灭细菌,而是精准地将其“重编程”为非毒性状态,同时赋予其分泌有益分子的能力,从根源上削弱致病性。这种方式规避了传统抗菌手段中的杀伤选择压力,因此更难诱导耐药性。更重要的是,BACTRINS 系统的模块化设计允许快速更换 gRNA 与治疗载体,理论上可拓展至多种致病菌与不同毒素靶点,如 Clostridium difficile、Bacteroides fragilis 等肠道致病菌种。
当然,研究也指出了未来临床转化中需要解决的难点。首先是如何在人体肠道中达到足够高的转移效率,并确保治疗菌株在肠道环境中生存与表达;其次是如何用无抗性标记的方式替代当前用于追踪实验的抗生素基因,以避免抗药性传播风险。此外,如何通过生物包被、定向递送等方式提升口服给药的稳定性和安全性,也是后续研究的重要方向。
总而言之,这项工作不仅展示了 CRISPR 转座酶技术在体内肠道编辑中的强大能力,也为抗感染治疗带来了全新的思路:不以杀为胜,而以改为先。通过合理设计遗传回路和功能载体,未来我们或许可以将病菌转化为治疗工具本身。这不仅是合成生物学的胜利,更是精准医学与微生态疗法交汇的前沿探索。
参考链接:
1Ronda, C., Perdue, T., Schwanz, L. et al. Precise virulence inactivation using a CRISPR-associated transposase for combating Enterobacteriaceae gut pathogens. Nat. Biomed. Eng (2025). https://doi.org/10.1038/s41551-025-01453-1
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有