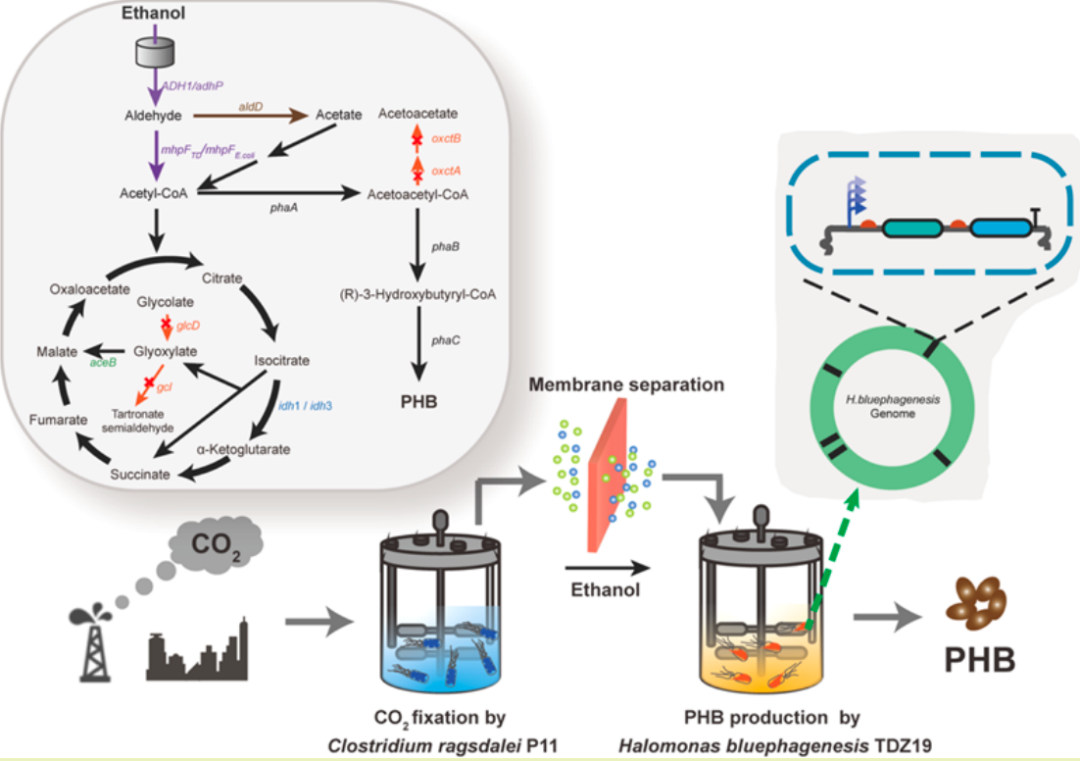
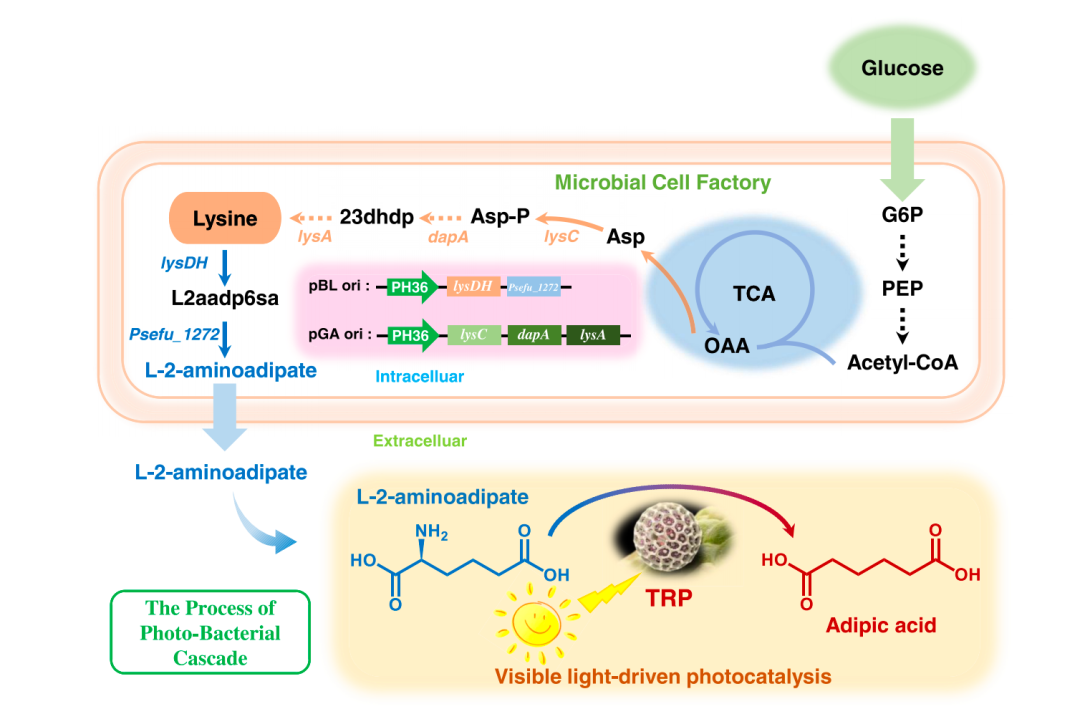
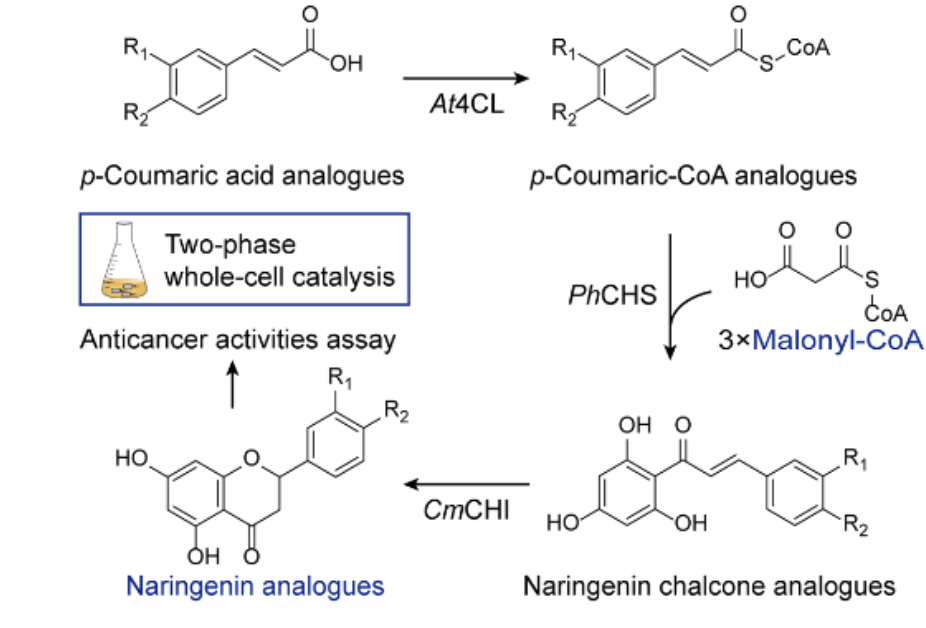
“我们发现了一种全新的癌症致死机制,并在 488 种癌症细胞系中首次成功验证了这类机制的普适性和选择性。这项研究为癌症新药研发带来新机会,有望惠及更多的癌症患者。”哈佛大学博士毕业生常亮表示。
这项研究来自美国麻省理工学院-哈佛大学博德研究所(Broad Institute of MIT and Harvard)团队,他们提出一种治疗癌症的新范式:通过信号通路过度激活来杀死癌细胞。

图丨常亮(来源:常亮)
审稿人对该研究评价称,“这一颠覆性的范式经过深入和全面的研究,致癌信号通路的过度激活可能对癌细胞的存活产生有害影响。Chang 等人通过展示致癌通路过度激活引起具有普适性的缺陷,在不同通路和癌症模型中都可以观察到。
并且,这些缺陷在已经携带过度激活通路突变的癌症中最为显著,它在很大程度上扩展了相关概念。这个开创性而全面的研究应该发表在一个高影响力的期刊上,以最大化这项研究的影响力。”

图丨相关论文(来源:Nature Genetics)

从“反常理”的思路确立治疗癌症的新范式
该研究源于塞勒斯此前发现的一个有趣的现象,他注意到,在带有 BRAF 突变的黑色素瘤细胞中,当用抑制剂去抑制信号通路时,癌细胞很快会出现耐药性;而在停药之后,肿瘤却反常的因为信号通路的继续激活而死亡。
也就是说,肿瘤对信号通路的抑制剂存在上瘾现象。在一次课题讨论中常亮提出,虽然这种现象是个例,但基于此做系统性的探索,能不能确认将信号通路激活作为一种杀灭癌细胞的新范式?
从癌症治疗手段来看,虽然近年来靶向治疗和免疫治疗已经为诸多癌症患者带来帮助,但是随着研究的深入,科学家们发现一种普遍现象,即靶向治疗中好的靶点似乎越来越少。
传统的癌症治疗范式是在信号通路被激活后,想办法抑制信号通路。在以往的认知中,癌症的信号通路过度激活,会导致癌细胞无限增殖。
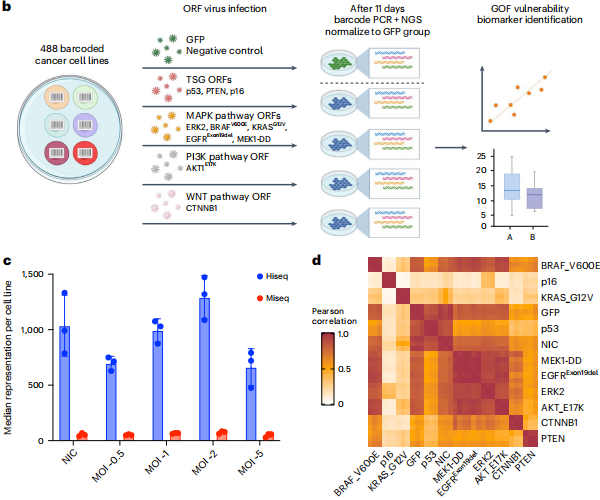
图丨488 种肿瘤细胞系中过度激活信号通路关键节点(来源:Nature Genetics)
而经过四年半的研究,该课题组通过系统的基因组学分析和功能实验,发现了一种意料之外的新机制:过度激活癌细胞赖以为生的信号通路反而会导致癌细胞死亡。“以其人之道还治其人之身”,是一种杀灭癌细胞的全新思路
并且,这不仅是在一种癌细胞的肿瘤模型的独特现象,而是具有普适性的机制。在 488 种癌症的细胞模型上,同时成功验证 MAPK、PI3K、WNT 三种癌症的主要信号通路中的 10 个信号通路节点。
常亮表示,“我们发现了一种治疗癌症的新范式,并在其中找到可以杀死特定癌细胞的一些新靶点。”

新认知:信号通路过度激活具有选择性
癌症患者在化疗时出现的脱发、出血以及胃肠不适等副作用,源于将正常细胞和癌细胞同时杀死。因此,选择性对于癌症治疗非常关键。
常亮解释说道:“理想的抗癌药物,比如最近 20 年来批准的一系列靶向治疗药物,不是同时将正常细胞和癌细胞杀死,而是有选择性地将癌细胞杀死。对未来的癌症新药,基于对癌细胞选择性杀伤的分子机制至关重要。”
令人欣喜的是,基于该研究来研发癌症新药,可能不会杀死所有的细胞,而是优先杀死癌细胞。
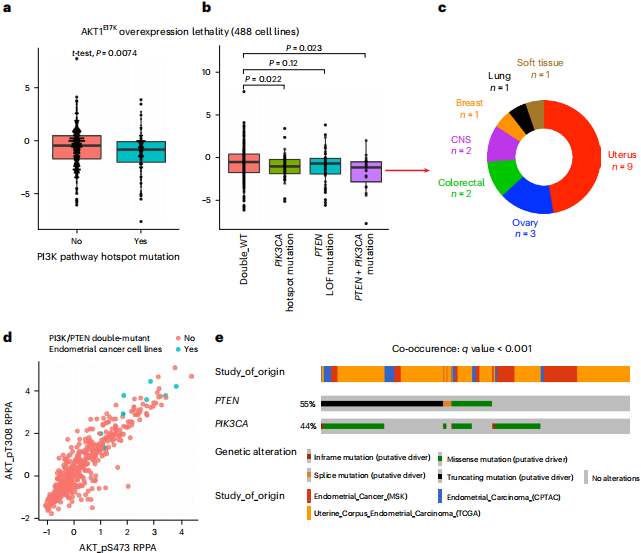
图丨PIK3CA/PTEN 双突变子宫癌细胞系中 PI3K 通路过度激活的选择性脆弱性(来源:Nature Genetics)
该团队在三种突变的癌细胞里发现了新靶点。值得一提的是,在存在 APC 突变的结直肠癌细胞上,该课题组发现过度激活 WNT 信号通路在突变后,可以将癌细胞杀死。
“对于有 APC 突变的细胞中的信号通路,很长时间之内,科学家们很难找到信号通路的抑制剂。如果这类疗法后续得以取得进展,则有可能惠及 70-80% 的结直肠癌患者。”常亮说道。
此外,他们还发现在约 30% 的子宫内膜癌细胞中,有 PI3CA 和 PTEN 这两个癌基因的双突变,过度激活 PI3K 信号通路会选择性的杀伤这些有双突变的癌细胞。

已成立初创公司进行产业转化
实际上,在 488 种癌症细胞中同时做通路激活实验及筛选,是一件极具挑战的事情。由于癌症细胞的生长速率、病毒感染效率等不尽相同,常亮为此投入了大量的时间和精力,仅在该方法优化和细节探索上就用了约两年多的时间。
在发现相关现象后,如何证实结果也是研究的难点之一。为此,该团队与合作者讨论和探索后,对比了近 7 万名相关患者的基因组,选择了和病人基因型相近的癌症类器官和小鼠模型实现成功验证。
他们发现信号通路的过度表达杀死了突变的类器官,而未突变的类器官则没有相关影响。在异种移植的 APC 突变肿瘤的小鼠中,相同信号的过度表达减缓了肿瘤的生长。
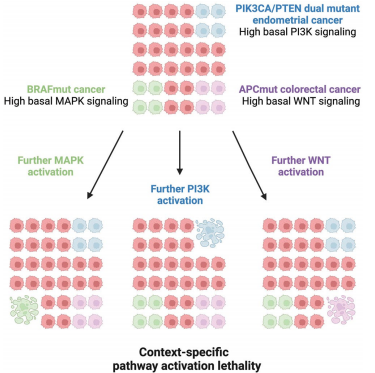
图丨信号通路过度激活合成致死的特异性(来源:Nature Genetics)
“我仍然记得实验分析结果出来那天是下着雪的平安夜,大家都去过圣诞节了,整层实验楼只有我自己,我激动得叫了出来!”常亮博士回忆道。
拿到分析结果后,他悬着的一颗心终于落地了。“当时心里比较忐忑,也承受了很大的压力,因为万一我们这个‘反常规’的方法行不通,我的博士毕业时间很有可能会延期。”他说。
该研究为癌症生物学的基础研究提供了更多的机会,并为黑色素瘤、结直肠癌和子宫内膜癌等新药研发打开了一扇新的“大门”,有望比传统的信号通路抑制手段有效和耐受性更强。
据悉,基于该成果塞勒斯教授作为联合创始人已成立初创公司 Delphia Therapeutics,并获得谷歌风投的支持。此外,该课题组还得到来自诺华的 50 万美元研究资金。
基于该研究,领域内的研究人员后续可进行一系列探索,例如研究癌细胞因过度信号通路激活而被杀死的具体机制,以及探索过度激活会引起哪些癌细胞和其他通路。
该课题组计划下一步研究激活更多的信号通路节点,从而建立更大的筛选数据集。另一方面,他们还打算探索如何能够通过将信号通路激活,从而更好地运用在癌症治疗中。
需要了解的是,该技术仍处于早期阶段,该研究展示了靶点发现环节中最早期的节点。“实际上,新药研发的周期比较长。从靶点发现、化合物筛选,再到发现先导化合物等一系列优化,到临床阶段至少需要 3 至 5 年,甚至更长时间。”常亮表示。

毕业后进入风险投资:探索癌症药物研发新前沿
在博士阶段,常亮致力于将基础研究的新发现转化为癌症新药,从而治疗及改善相关的癌症患者。
此前,常亮通过研究过去 20 年癌症靶向药物研发的失败经历,发现一类错误的研发范式:很多大家觉得理所当然的“选择性”癌症靶点其实是正常细胞也广泛需要的全基因组必需基因(pan-essential genes),从而导致治疗窗口的狭窄和极高的失败率。2021 年,相关论文发表在 Cancer Cell [2]。
常亮的博士导师塞勒斯教授曾长期担任诺华生物医学研究所负责癌症研发的全球副总裁,他在 2016 年加入哈佛大学和麻省理工学院-哈佛大学博德研究所任教。得益于其累积的丰富工业界经验,常亮也从塞勒斯教授身上学到很多产业化的知识和思维,例如将科研成果转化为新药的多种因素。

图丨常亮在博士毕业答辩(来源:常亮)
2023 年 6 月,常亮在博士毕业后,加入了位于美国波士顿一家风险投资机构,从事生物医药风险投资和公司孵化相关的工作。他表示,“现在我会以投资人的视角,通过我的科研背景深入发掘与癌症相关的、有潜力的科研成果,并与科学家们共同将基础科研成果转化为商业化新药。”
过去的几十年,已经有很多癌症相关新药陆续被研发出来,并有很多癌症患者因此受益。“但其实做得还不够好,大多数癌症患者现在并没有可用的靶向药物,很多患者普遍存在癌症耐药的问题。”常亮说。也就是说,在起初用药阶段效果或许还不错,但不可忽视的是,癌症的复发率极高且容易出现转移现象。
他指出,在癌症新药研发领域想要解决上述问题,有两类思路值得学术界和工业界共同探索:第一,怎么样找到新的靶点,能够让对抗癌症的新药“武器库”更庞大;第二,如何解决癌症耐药的问题。
癌症新药“武器库”更庞大,意味着在癌症患者在出现耐药性之前,就能够研发出新药并及时治疗。在解决耐药性方面,可通过在临床与相关药物联用、精准医疗等方法,争取在最短时间内找到解决方案。“另外,在基础研究方面,我认为也需要不断地探索将患者耐药率降低的新机制。”常亮最后说道。
参考资料:1.Chang, L., Jung, N.Y., Atari, A. et al. Systematic profiling of conditional pathway activation identifies context-dependent synthetic lethalities. Nature Genetic 55, 1709–1720 (2023). https://doi.org/10.1038/s41588-023-01515-72.Chang, L. et al. Targeting pan-essential genes in cancer: Challenges and opportunities. Cancer Cell 39, 4,466-479, 12(2021). https://doi.org/10.1016/j.ccell.2020.12.008

























































































安各洛(深圳)生物科技有限公司 版权所有