在合成生物学研究中,对细胞内蛋白质丰度的精准调控是解析基因功能、构建人工生物电路和优化代谢通路的核心手段。与 DNA 或 RNA 水平的调控相比,直接在蛋白质水平进行降解调控具有响应速度快、可调性高且无需基因组修饰等显著优势,尤其适用于研究必需基因功能和调控特定细胞器内的蛋白水平。
近年来,真核生物中的蛋白质降解技术取得了快速发展,如 PROTACs、分子胶和 LYTACs 等化学诱导策略,以及 degronLOCKR 等基于降解标签的融合系统,已成为疾病相关蛋白研究和治疗开发的有力工具。然而,原核生物中的蛋白质降解方法仍存在明显局限,现有技术主要依赖化学降解剂或降解标签融合,前者成本高昂且受膜通透性限制,后者需预先修饰靶蛋白,操作繁琐且可能干扰蛋白功能,严重制约了细菌合成生物学的发展。
针对这一瓶颈问题,江南大学刘立明、高聪等人近日在 Nature Communications 发表了一篇题为“De novo designed protein guiding targeted protein degradation”的研究成果。
研究团队首次开发出一套无需标签、无需预处理、可即插即用的合成蛋白降解平台——GPlad 系统(Guided Protein Labeling and Degradation),该系统整合了从头设计的向导蛋白与内源性蛋白酶系统,实现了无需预先修饰靶蛋白的精准降解,为原核生物蛋白质调控提供了创新的解决方案。
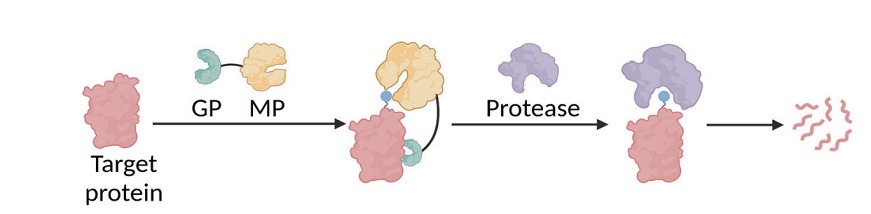
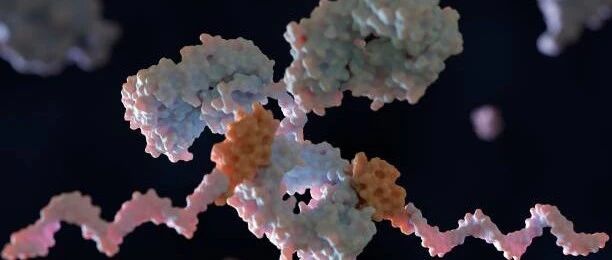
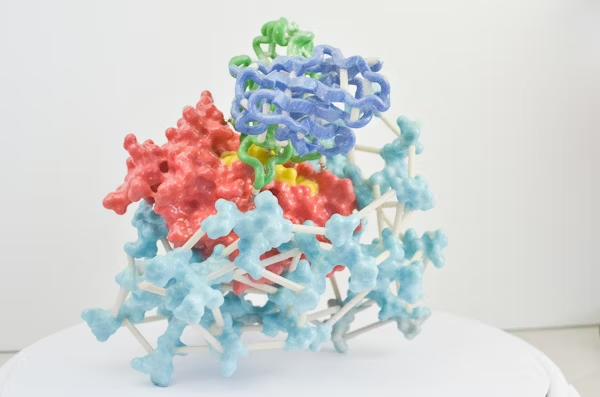
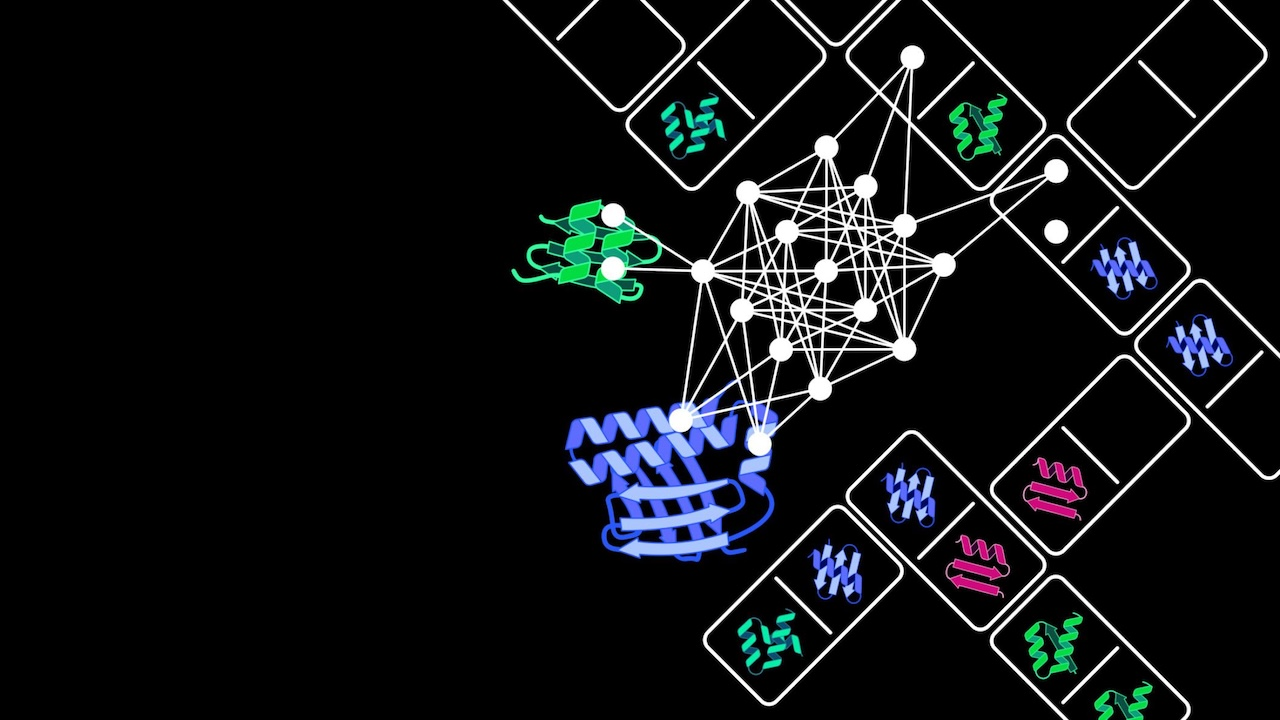
图 | GPlad 系统工作的核心原理
GPlad 系统的核心原理是:利用计算设计生成特异性引导蛋白(Guide Protein, GP),使其识别目标蛋白的特定表面区域,进而牵引作为标记蛋白(MP)的 McsB 靠近目标位点。其中,McsB 是源自枯草芽孢杆菌的精氨酸激酶,作为该系统中发挥标记功能的 MP,它能将目标蛋白的精氨酸残基磷酸化以形成“降解信号”,随后该信号可被 ClpC 识别,目标蛋白被转运至 ClpP 进行水解。整个过程不依赖融合标签或化学小分子,仅通过引导蛋白的精确定位,即可实现对天然蛋白的降解识别。在大肠杆菌模型中,该团队以荧光蛋白 mKate2 为示范,展示了引导蛋白 GPmKate2 与 McsB 融合后,可在 6 小时内使 mKate2 荧光强度下降 80% 以上,验证了系统的有效性和通用性。
相比以往基于融合 degron 标签的策略,GPlad 的最大优势在于无需对目标蛋白进行预修饰,这一创新使得系统可广泛适用于研究内源蛋白、生物合成酶甚至外源表达的人源蛋白。例如,研究人员构建了针对大肠杆菌抗生素抗性蛋白 ErmB 和代谢酶 AroK 的引导蛋白,发现在不改写基因组的前提下,仅通过表达 GPlad 系统,即可分别抑制细胞对红霉素的耐受性或芳香族氨基酸的合成,展现出显著的表型变化。此外,GPlad 还成功降解了来自人源 FGFR2 和立克次体 VirB8 等异源蛋白,蛋白水平分别降低 76% 和 85%,验证了系统对不同结构来源蛋白的普适降解能力。
为了增强系统的调控灵活性,研究团队还开发了三个功能拓展模块。
其一,antiGPlad 系统,通过设计一个特异性结合标记蛋白 McsB 活性位点的蛋白抑制剂(antiMcsB),可实现对 GPlad 降解过程的可逆关闭,相当于为降解机制增加了“开关”装置。
其二,OptoGPlad 系统利用蓝光诱导的蛋白二聚机制(Magnet 系统),在蓝光照射下激活降解反应,黑暗中则终止反应,可实现远程、非接触式的蛋白降解控制。
其三,GPTAC 系统则模仿小分子 PROTAC 的思路,通过两个引导蛋白分别结合目标蛋白与标记蛋白 McsB,组成生物降解连接器,可支持模块化设计以及多靶点同步降解,进一步拓展了系统应用范围。
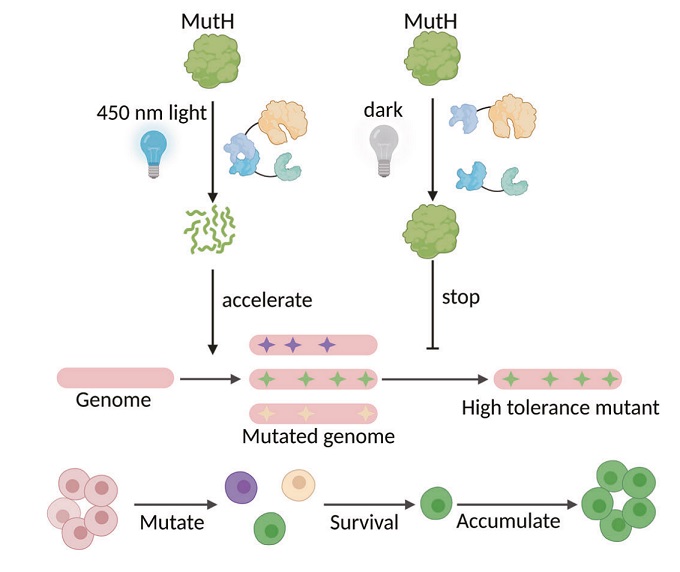
图 | OptoGPlad 模块功能示意图
在实际应用层面,GPlad 及其模块更是展现出强大的生物工程潜力。在构建合成蛋白电路方面,团队基于 GPlad 与 antiGPlad 设计了三种“蛋白逻辑模块”:一是可逆开关,在添加诱导剂后,目标蛋白先被 GPlad 降解,随后通过 antiGPlad 表达恢复;二是信号放大器,通过正反馈环路使低浓度诱导剂也能显著提升蛋白表达量;三是蛋白振荡器,通过引导蛋白与其抑制蛋白间的负反馈,构建出蛋白周期性表达系统,为未来高阶合成生物装置提供构件基础。
此外,该系统也在加速细胞进化和提升发酵产量方面展现出巨大应用潜力。研究团队以 OptoGPlad 降解 DNA 修复酶 MutH,大大提高了突变率,从而加速菌株演化,他们仅用 100 代便筛选出在高毒性 PCA(原儿茶酸)胁迫条件下仍具有 88% 存活率的耐受菌株,相比传统方法(220代)效率提升超一倍。在发酵产物调控方面,他们则利用 GPTAC 系统实现了对 AroE 蛋白的时序性降解,使得菌体先正常生长,后转为高效合成 3-脱氢莽草酸(DHS),最终在 5 L 发酵体系中产物浓度达 92.6 g/L,比传统 CRISPRi 法提高 23.8%。
总之,该研究首次在原核生物中实现了基于从头设计蛋白的靶向降解系统的系统性验证,其技术路线突破了传统方法对预修饰靶蛋白或化学试剂的依赖,在操作的便捷性与应用的通用性上展现出显著优势,为细菌合成生物学研究、微生物细胞工厂构建及抗感染治疗等领域开辟了新路径。
参考文献:
1. Li, Z., Qiao, G., Wang, X. et al. De novo designed protein guiding targeted protein degradation. Nat Commun 16, 6598 (2025). https://doi.org/10.1038/s41467-025-62050-z
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































































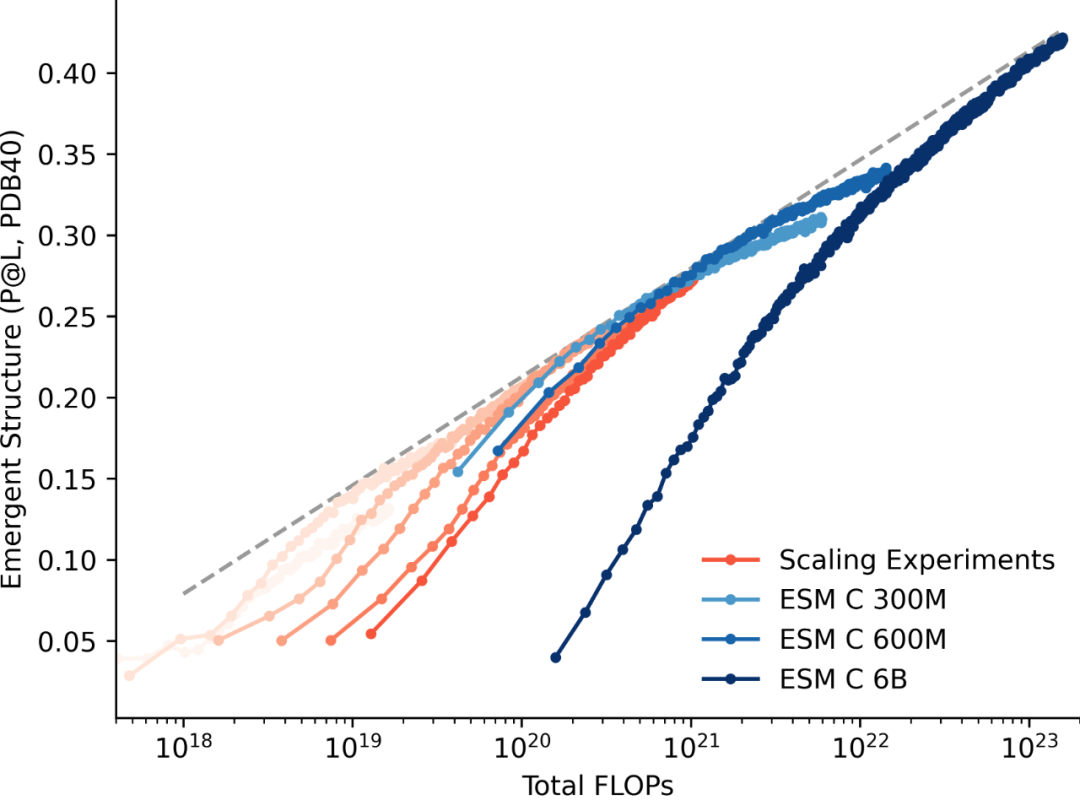

































































安各洛(深圳)生物科技有限公司 版权所有