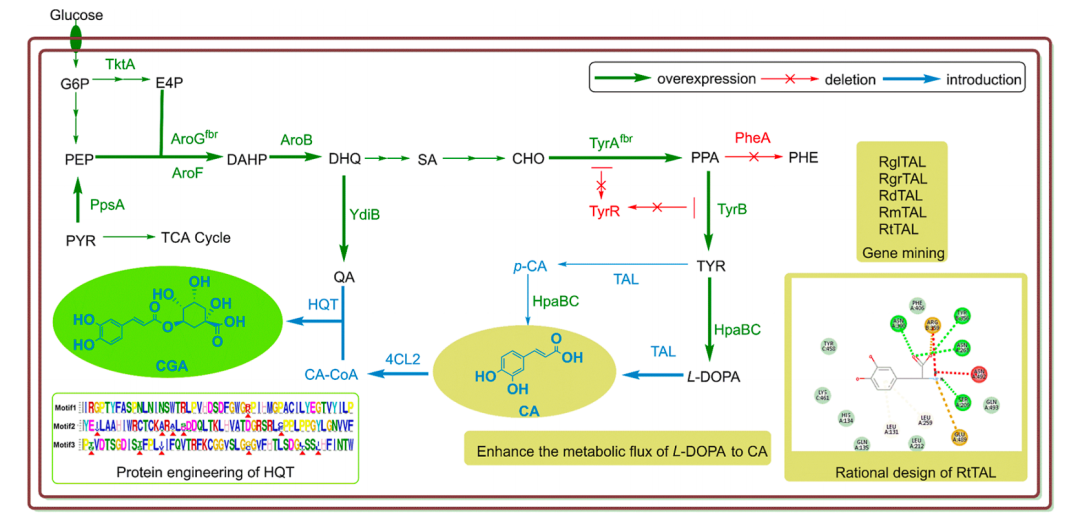
在对抗实体瘤的探索中,厌氧菌因其能够主动穿越肿瘤屏障、精准富集于缺氧区域,一直被视为极具潜力的“活体导弹”。然而,传统工程菌由于致病性强、改造复杂、安全性存疑等因素,在临床应用中始终面临巨大挑战。
近期,华中科技大学杨祥良和王芹团队在 Nature Communications 上报道了一项突破性研究,题为“Living therapeutics of nonpathogenic bacteria as biosynthesis factory and active carriers for enhancing tumor-targeted therapy”。他们利用天然非致病的硫酸盐还原菌(SRB),构建出一种兼具靶向性与治疗能力的 FeS@SRB 生物杂化体,显著提升了肿瘤靶向效率和协同治疗效果,为活体菌载体的安全高效应用开辟了新路径。

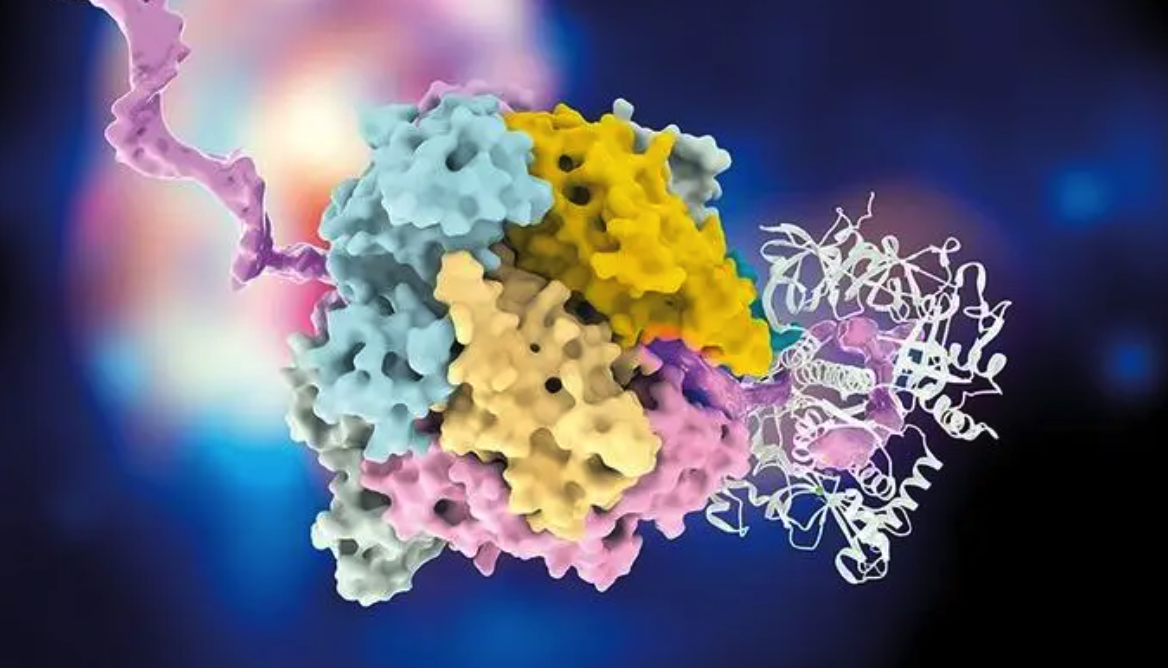
SRB 本身具有天然厌氧性和良好的宿主相容性,且广泛存在于人体肠道等环境中。作为严格厌氧菌,它能主动向肿瘤内部的缺氧区迁移。其代谢特性尤为关键,SRB 可以通过细胞色素系统将硫酸盐(SO₄²⁻)还原为硫化物(S²⁻)。研究团队利用 SRB 将硫酸盐还原为硫化物,再与培养体系中的亚铁离子(Fe²⁺)反应,在细菌表面原位生成硫化亚铁纳米颗粒。这一过程无需外加修饰剂或外源反应体系,实现了活菌和功能纳米材料的一步杂化,形成独特的 FeS@SRB 生物杂化体。该策略不仅完整保留了 SRB 的活性和自主运动能力,也避免了传统化学修饰可能造成的功能损失或毒性风险。
靶向效率低下是纳米药物面临的普遍难题。传统化学合成的 FeS@BSA 纳米颗粒,依赖肿瘤组织的高通透性和滞留效应(EPR 效应被动靶向),静脉注射后在肿瘤部位的富集率仅有 2.9%。而 FeS@SRB 的治疗优势首先体现在其惊人的肿瘤富集效率。在 4T1 乳腺癌模型中,静脉注射后,FeS@SRB 在肿瘤部位的荧光强度占比高达 50.5%,靶向效率是传统纳米颗粒的 17 倍以上。在体外缺氧模型和三维肿瘤球实验中,FeS@SRB 也表现出显著的深层穿透优势,验证其对肿瘤微环境的天然趋化响应。
到达肿瘤后,FeS@SRB 如何发挥治疗作用?答案是协同。在弱酸性肿瘤环境中,FeS 释放 Fe²⁺,催化过氧化氢生成羟基自由基,通过 Fenton 反应诱导细胞凋亡;同时,FeS 具备优异的光热转换能力,经近红外激光照射后可迅速升温至 55°C,对瘤体实现局部热消融。这两种治疗机制不仅相互独立又彼此增强。热效应可提升 Fenton 反应效率,加剧氧化应激,从而放大铁死亡与凋亡路径。RNA 测序结果显示,治疗激活了多条细胞应激和死亡信号通路,包括 GPX4 下调、ACSL4 上调及 p53 相关机制等,为其协同效应提供了分子支撑。
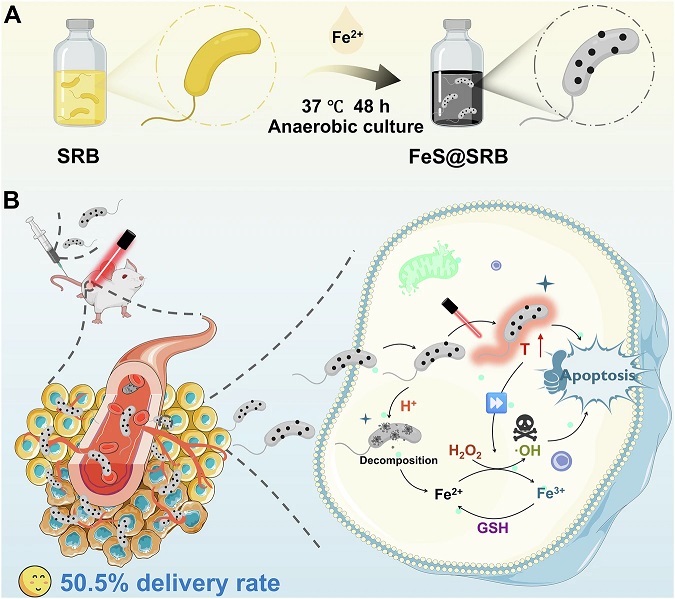
图 | FeS@SRB 的形成及协同治疗机制
FeS@SRB+激光处理在多种小鼠肿瘤模型中均取得显著效果。在 4T1 皮下、B16F10 黑色素瘤以及原位 4T1 模型中,均观察到明显的瘤体缩小,部分小鼠实现完全缓解,同时生存期显著延长。对照组中无论是否使用激光或替代纳米颗粒,治疗效果均远逊于 FeS@SRB 组,凸显其协同治疗的独特优势。
在安全性评估方面,研究显示 SRB及FeS@SRB 对正常细胞的毒性极低,红细胞溶血率低,亦未诱发异常凝血反应。动物实验中,仅在注射后短时间内检测到轻微炎症因子升高,随后迅速恢复,未见慢性炎症迹象。血液学和生化指标长期维持正常,H&E 组织切片亦未观察到器官损伤。此外,注射后第四天,SRB 在主要脏器中已基本不可检出,体重增长趋势稳定,进一步支持其良好的体内代谢与安全性。
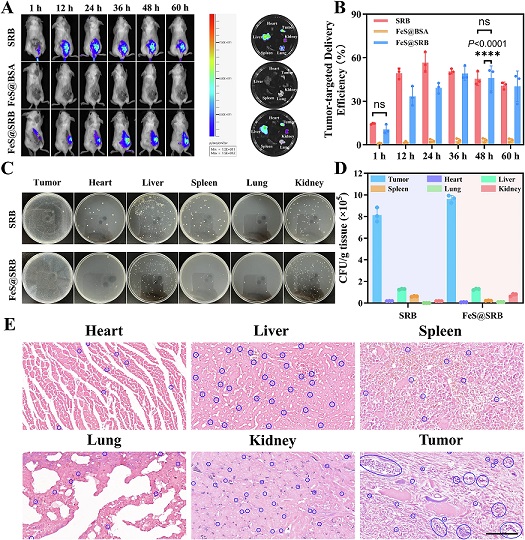
图 | FeS@SRB 在体肿瘤靶向特性验证
除直接杀伤作用外,FeS@SRB 还诱导了有效的抗肿瘤免疫应答。治疗后,肿瘤引流淋巴结中成熟树突状细胞显著增加,肿瘤组织内的 CD8+与CD4+ T 细胞浸润增强,促炎细胞因子水平升高,表明 FeS@SRB 具备激活体液与细胞免疫的能力,有望协助建立长期抗肿瘤记忆。
这项研究展示了一种无需基因工程修饰即可实现高效靶向与协同治疗的活体治疗策略,通过借力天然非致病菌的代谢能力与生物相容性,将合成材料与生物载体完美整合,体现了合成生物学在活体治疗领域的巨大潜力。未来,该平台可拓展至合成其他类型金属硫化物,匹配不同治疗机制,如声动力、催化疗法等,有望推动生物杂化体在精准抗癌方向的更广泛应用。
参考链接:
1.Dong, M., Yang, X., Zhang, W. et al. Living therapeutics of nonpathogenic bacteria as biosynthesis factory and active carriers for enhancing tumor-targeted therapy. Nat Commun 16, 6532 (2025). https://doi.org/10.1038/s41467-025-61675-4
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有