D-2,3-丁二醇是一种具有广泛工业应用前景的重要手性平台化合物,可作为合成高值化学品(如甲基乙基酮、1,3-丁二烯和可降解聚合物单体)的关键中间体,也能作为医药和香料工业的原料。其光学纯度直接决定下游产品的性质,因此实现高产率、高光学纯度的定向生物合成一直是代谢工程的重要目标。然而,自然界中能够高效合成光学纯 D-2,3-丁二醇的微生物十分有限,多数菌株存在副产物竞争、还原力不足及调控复杂等问题,难以满足工业化需求。
针对这些瓶颈,奥本大学研究团队提出了以功能基因移植与系统优化为核心的理性代谢工程策略,通过从天然高产菌中解析关键基因并在枯草芽孢杆菌中重构其代谢通路,最终实现了光学纯 D-2,3-丁二醇的高效合成,产量达 34.1 g/L,产率接近理论值的 92%。相关成果以“Deciphering D-2,3-Butanediol Metabolic Pathways in a Newly Isolated Bacillus velezensis and Rationally Engineering Bacillus subtilis for Efficient Production of Optically Pure D-2,3-Butanediol”为题发表于 ACS Synthetic Biology。
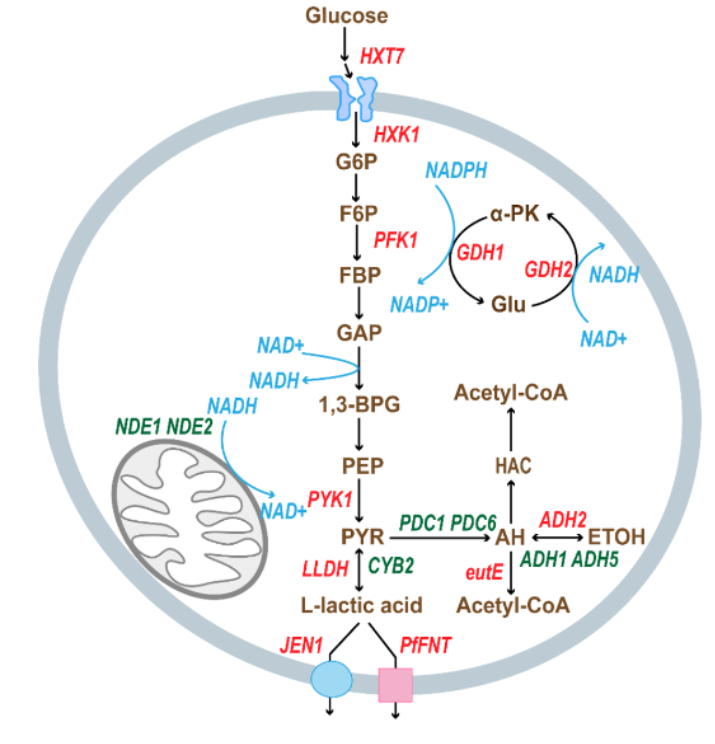
研究的起点是一株名为贝莱斯芽孢杆菌 FJ-4 的天然菌株,该菌能以 0.44 g/g 葡萄糖的高产率合成光学纯度超过 99.9% 的 D-2,3-丁二醇。通过全基因组测序与比较分析,研究团队锁定了参与该代谢过程的关键基因。其中,bdhA 基因编码的丁二醇脱氢酶催化乙酰转化为 D-2,3-丁二醇,是决定产物立体专一性的关键酶,而 nadC 基因则参与 NAD+ 的从头合成,可能通过调控细胞内 NADH/NAD+ 比例影响产物生成。然而,FJ-4 难以接受外源 DNA,无法直接进行基因操作,这使得其代谢机制的解析及进一步改造受限。
为突破这一瓶颈,研究团队采用了功能基因移植策略,将 FJ-4 中的核心基因转入遗传背景清晰、易于编辑的 枯草芽孢杆菌 168。利用 CRISPR-Cas9 系统,他们以模块化思路开展了系统代谢工程。首先,研究人员在宿主菌中删除自身的 bdhA 基因,获得完全丧失丁二醇合成能力的突变株 BS01。随后将 FJ-4 来源的 bdhA 导入该菌株,成功恢复了 D-2,3-丁二醇的合成功能,产量达 8.9 g/L,验证了该基因对 D 型异构体形成的决定性作用。
图 | 关键基因 bdhA 的敲除与异源表达验证
在此基础上,为减少副产物对碳流的竞争,研究者依次敲除了乳酸脱氢酶(ldh)和磷酸转乙酰酶(pta)基因,构建的 BS05 菌株几乎不再生成乳酸,乙酸产量显著下降,D-2,3-丁二醇产量提升至11.0 g/L,产率达到 0.44 g/g。进一步地,为改善细胞的还原力供应,他们在 BS05 中敲除了 nadC 基因,使细胞内 NADH/NAD+ 比例在指数生长期提升 3.9 倍,驱动了更强的还原代谢能力。该改造后的 BS06 菌株产量提升至 13.0 g/L,产率达 0.47 g/g,相当于理论最大值的 94%。
图 | 副产物路径删除与辅因子平衡调控
在优化还原力的同时,团队强化了上游代谢通路以提升前体供应。通过在染色体上过表达乙酰乳酸合酶与乙酰乳酸脱羧酶操纵子(alsSD),他们增强了从丙酮酸到乙酰乳酸的转化效率,最终获得了性能最优的 BS08 菌株。该菌在发酵 168 小时后 D-2,3-丁二醇产量达到 34.1 g/L,产率为 0.46 g/g 葡萄糖,光学纯度保持在 99.9% 以上,产率达到理论最大值的 92%。
研究进一步揭示了发酵条件对产量的影响。低搅拌速率(100 rpm)下的低溶氧环境有利于维持较高的 NADH 水平,从而促进还原产物积累;而在高搅拌速率(180 rpm)下,氧气供应增加导致还原力下降,产物更多转向乙酰生成。为应对此现象,研究人员在 BS08 中整合了甲酸脱氢酶基因(fdh),通过催化甲酸氧化生成二氧化碳的同时再生 NADH,以弥补高氧条件下的还原力不足。优化后的菌株 BS09 在 180 rpm 搅拌条件和 3 g/L 甲酸钠补充下,D-2,3-丁二醇的容积生产率达到 0.22 g/(L·h),较BS08 在相同高转速条件下提升 10%,表现出较强的工业放大潜力。
整体来看,该研究实现了从天然高产菌的基因解析到可操作宿主的理性重构,形成了一条清晰的模块化代谢工程路径。研究团队在每个阶段均针对代谢网络的关键节点进行精确调控:通过功能基因导入建立立体专一性合成能力,清除副产物通路以集中碳流,调节辅因子平衡以提升还原代谢强度,并最终通过强化前体生成实现系统增效。这一系列策略使产量从最初的 6.8 g/L 提升至 34.1 g/L,展示了代谢工程设计的累积效应与科学逻辑。
该工作的重要意义不仅在于实现了光学纯 D-2,3-丁二醇的高效合成,更在于提出了一种可扩展的工程范式。通过系统化地整合基因组解析、代谢流重定向与辅因子再生设计,研究人员为绿色生物制造提供了通用思路。这种模块化策略能够推广至其他高附加值化学品的微生物合成中,尤其适用于需要同时兼顾产率、纯度与能量平衡的复杂代谢体系。研究成果不仅展示了合成生物学在精准调控代谢网络方面的能力,也为实现可持续化学工业提供了技术支撑。
参考链接:
1. Guo N, Wang S, Whitfield CT, et al. Deciphering D-2,3-Butanediol Metabolic Pathways in a Newly Isolated Bacillus velezensis and Rationally Engineering Bacillus subtilis for Efficient Production of Optically Pure D-2,3-Butanediol. ACS Synth Biol. Published online 2025. doi:10.1021/acssynbio.5c00445
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有