在生物制造领域,如何实现高效、可编程的小分子生物合成平台是一个长期挑战。二醇、氨基醇和羟基酸广泛应用于工业溶剂、聚合物单体、医药中间体和化妆品添加剂。然而,现有的代谢工程方法主要依赖于针对单一目标分子的优化,缺乏通用性,难以灵活拓展至更多产品。
针对这一问题,加州大学伯克利分校 Jay Keasling课题组的研究人员近日开发了一种基于聚酮合酶(PKS)的模块化生物合成平台,突破了传统代谢工程的瓶颈,实现了中链和支链二醇、氨基醇及羟基酸的高效生物合成,为精准设计微生物合成路径提供了新的解决方案。文章以题为“A polyketide-based biosynthetic platform for diols, amino alcohols and hydroxy acids”发表于 Nature Catalysis 期刊。
这项工作的第一作者但青云本科毕业于北京大学生命科学学院,获得生物学学士学位。随后,他在密歇根大学安娜堡分校接受博士训练,并在 Janet Smith 教授的指导下获得生物化学博士学位。他的博士研究主要聚焦于真菌吲哚生物碱的生物合成机制解析,期间鉴定并表征了依赖还原反应的 Diels-Alder 环化酶,揭示了该酶在生物合成途径中的关键作用。之后加入加州大学伯克利分校,在 Jay Keasling 教授的实验室从事博士后研究,致力于基于聚酮合酶(PKS)的生物合成平台构建。

I 型聚酮合酶(Type I PKS)作为一类高度模块化的酶系统,在自然界中负责合成多种复杂次级代谢产物,如抗生素、免疫抑制剂和其他生物活性分子。PKS 的合成能力源于其模块化结构,其功能模块包括酰基转移酶(AT)、酮合成酶(KS)、酮还原酶(KR)、脱水酶(DH)、烯酮还原酶(ER)和酰基载体蛋白(ACP)等,每个模块分别决定中间体化合物的结构及官能团修饰,并最终决定产物的化学结构。这种模块化特性使其成为可编程的生物合成工具,能够在 DNA 水平上调整其功能模块,以生成不同的目标产物。
传统的 PKS 通常利用硫酯酶(TE)终止生物合成路径,通常生成羧酸或内酯类化合物。然而,这种方法无法直接合成醇类或氨基醇化合物,限制了其在生物制造中的应用。本研究提出了一种新的合成策略,即 PKS-TR 平台,以硫还原酶(TR)替代传统的硫酯酶,使得 PKS 系统能够在链终止时生成醛,并进一步转化为醇或氨基醇,从而突破传统 PKS 生物合成的化学局限性。
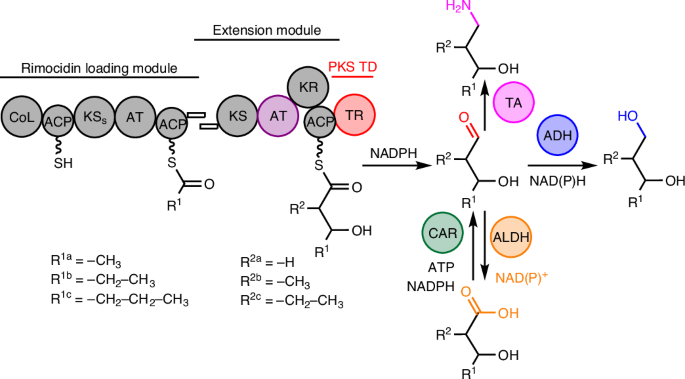
在本研究中,研究人员首先对 TR 的功能进行了深入解析,以明确其在调控最终产物类型中的作用。系统的谱系分析表明,TR 属于短链脱氢酶/还原酶(SDR)家族,并在多个链霉菌属(Streptomyces)的聚酮合酶系统中独立进化,表明其在微生物次级代谢中的广泛性。生物化学分析表明,TR 依赖 NADPH 进行催化,能够特异性识别 ACP-结合的聚酮硫酯中间体,并将其高效转化为醛,同时无法进一步还原为醇。TR 对 ACP-结合的底物具有显著的亲和力,而对游离硫酯底物的催化效率较低,这一特性确保了其在 PKS 系统中的高度专一性。
在此基础上,研究人员针对目标小分子结构优化了 PKS 的装载模块选择,利用 Rimocidin PKS 的装载单元,使其能够适配多种起始底物,如乙酰辅酶 A、丙酰辅酶 A 和丁酰辅酶 A,从而为二醇和氨基醇合成提供了多样性基础。装载模块的优化为不同类型的中间体生成奠定了基础,使 PKS 能够灵活接受不同的初始底物。
针对延伸模块,研究人员通过引入特定的酰基转移酶,实现了对甲基/乙基-丙二酰辅酶 A 的选择性加载,使合成产物能够带有支链结构。这一策略使得 PKS 能够生产中链和支链二醇,拓展了该生物合成平台的分子多样性。
在终止模块优化方面,研究人员通过硫还原酶替代传统的硫酯酶,并结合醇脱氢酶(ADH)的过表达筛选,最终在白色链霉菌(Streptomyces albus J1074)中实现了 1,3-二醇的高效生物合成。实验表明,该系统成功合成了 9 种 1,3-二醇,包括 1,3-丁二醇、1,3-己二醇和 2-乙基-1,3-己二醇(2-E-1,3-HDO)等,其中摇瓶内的最高二醇产量可达到1008.5 mg/L。此外,通过过表达巴豆酰辅酶 A 羧化酶/还原酶以及增加 L-缬氨酸供给,最终提高 butyryl-CoA 的底物浓度的方式,研究人员进一步优化了 1,3-己二醇的合成,使其产量达到 779.4 mg/L,证明了通过调控底物池来有效调控该平台产物合成的可行性。
值得注意的是,该研究还首次在微生物中实现了 2-乙基-1,3-己二醇的生物合成。该化合物作为重要的化妆品原料和溶剂,在工业上具有广泛的应用前景。在 2-乙基-1,3-己二醇的合成过程中,研究人员发现仅依赖 TR 和 ADH 无法生产目标化合物,还需同时过表达羧酸还原酶(CAR)。通过调整 PKS 的装载和延伸模块,并结合优化的醇脱氢酶,该团队成功实现了该化合物的生产,为未来进一步优化其生物合成奠定了基础。
除了二醇合成,该研究还探索了 PKS-TR-TA(转氨酶)策略,成功实现了氨基醇的高效生物合成。氨基醇是一类重要的医药和精细化工中间体,传统的生物合成方法通常依赖于特定的氨基酸前体骨架,导致目标产物的可选择范围较低。本研究通过 TR 终止后结合特异性转氨酶(TA),实现了 1-氨基-3-己醇、1-氨基-3-戊醇等氨基醇分子的生物合成。此外,研究人员通过调控底物池,使 1-氨基-3-己醇的产量从 17.1 mg/L 提高至 364.4 mg/L。这一结果表明,PKS-TR-TA 策略能够进一步丰富 PKS 系统的合成产物类别,为生物制造氨基醇及其衍生物提供了全新的方法,也为未来相关药物分子的生物合成奠定了基础。
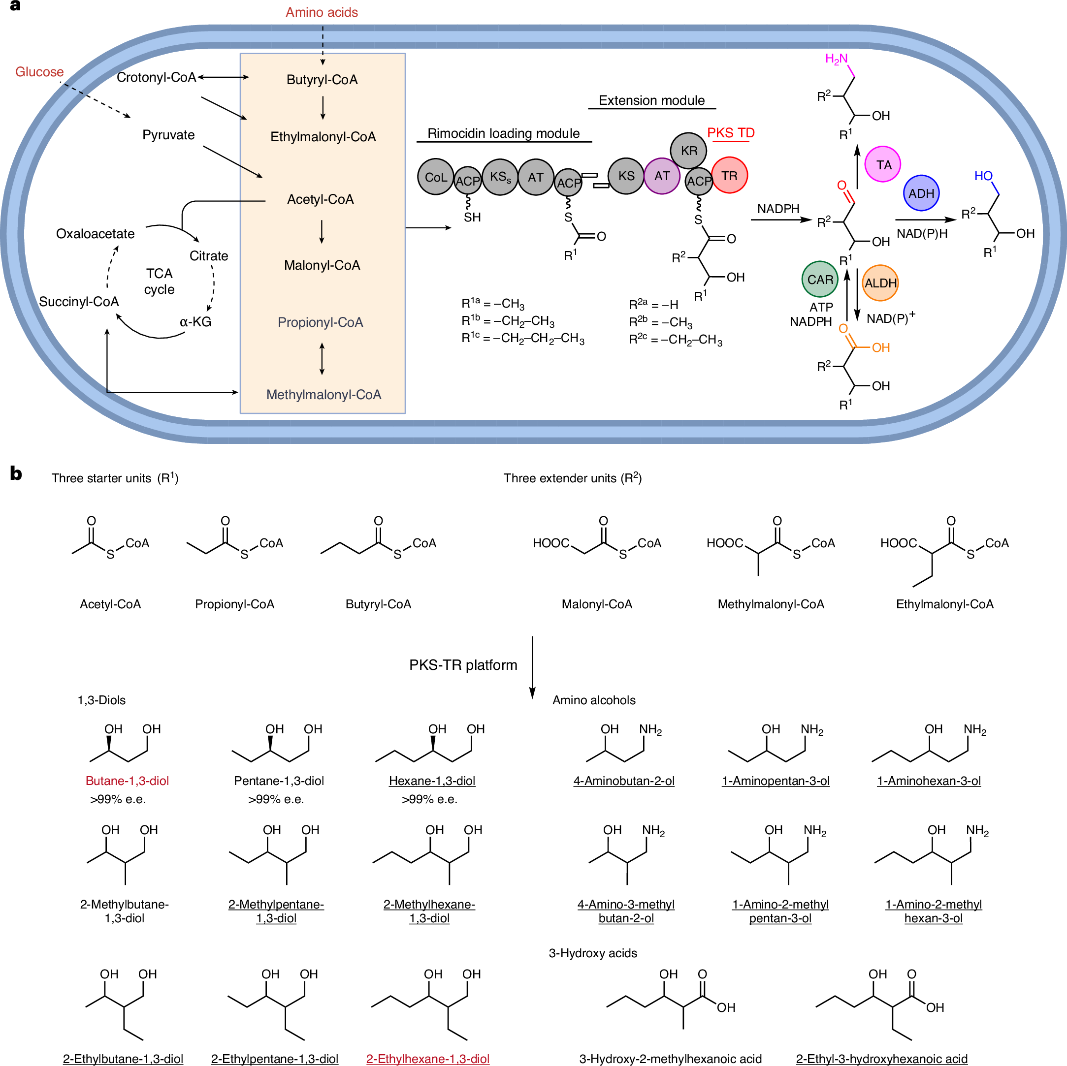
本研究成功开发了一种基于聚酮合酶-硫还原酶的可编程生物合成平台,首次在微生物中高效合成了多种二醇、氨基醇和羟基酸,为精准生物制造提供了新策略。这一研究为未来基于聚酮合酶的合成生物学和代谢工程的进一步发展提供了新的可能性。
参考链接:
1. Dan, Q., Chiu, Y., Lee, N. et al. A polyketide-based biosynthetic platform for diols, amino alcohols and hydroxy acids. Nat Catal (2025). https://doi.org/10.1038/s41929-025-01299-5
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有