在精准免疫治疗需求日益增长的今天,如何高效、特异性地识别病变细胞,尤其是携带微弱病理信号的癌细胞和病毒感染细胞,成为制约 T 细胞疗法普及的关键瓶颈。细胞表面的 I 类主要组织相容性复合体(MHC-I)通过呈递内源性肽段实现免疫监视。当细胞感染病毒或发生癌变时,MHC-I 会展示疾病相关肽段形成 pMHC-I 复合物,成为 T 细胞受体(TCR)识别的靶标。然而,天然 TCR 对特定 pMHC 复合物的识别效率有限,且传统方法(如 TCR 筛选或单链抗体 scFv 开发)面临成本高、周期长、难以覆盖人类群体 HLA 多样性等问题,制约了精准免疫治疗的发展。
近期,由华盛顿大学 David Baker 教授团队牵头,联合斯隆·凯特琳纪念癌症中心、斯坦福大学、华盛顿大学蛋白设计研究所等机构组成的多中心研究团队,在 Science 杂志上发表了题为“Design of high-specificity binders for peptide–MHC-I complexes”的突破性成果,利用生成式人工智能(generative AI)设计出了高特异性 pMHC 结合的“人工 TCR”。

研究通过 RFdiffusion 与 ProteinMPNN 相结合的 AI 工具链,构建出 11 种具有高特异性、高亲和力的 pMHC-I 复合物结合蛋白,其中 8 种在改造的 CAR-T 细胞中实现了对呈递病理肽段靶细胞的精准识别与激活。更值得关注的是,该策略成功覆盖病毒、肿瘤相关抗原及新抗原等多个类别靶点,并在预测结构基础上实现了对无解析结构靶点(如 PRAME)的功能化设计,展现出广泛适用性与工程化潜力。
研究聚焦于 MHC-I 分子呈递的短肽,该复合物构成了 T 细胞识别病变细胞的关键标志。由于肿瘤或病毒感染引发的抗原通常只涉及少数几个氨基酸的变化,传统的识别策略如 TCR 筛选或抗体片段设计难以在特异性、效率和成本之间取得平衡,且难以覆盖不同 HLA 等位基因与肽段组合的广泛多样性。该研究通过 AI 主导的从头设计策略,成功规避了上述瓶颈。
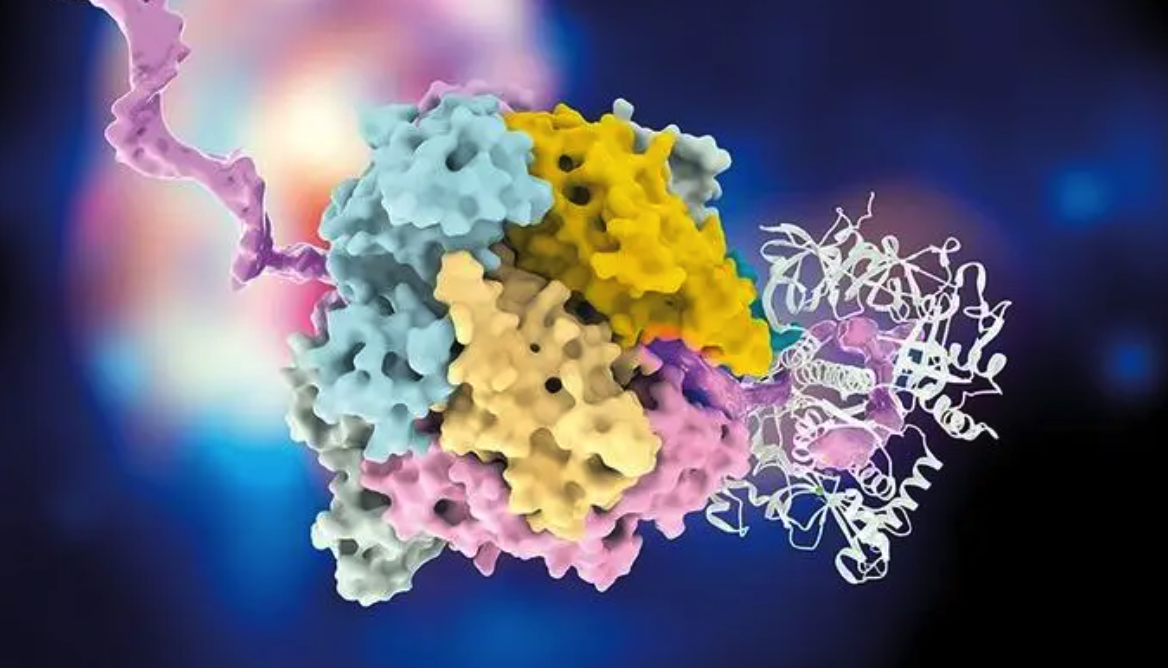
该平台整合 RFdiffusion、ProteinMPNN与AlphaFold2/3 三项核心技术,建立了一套高效的蛋白质设计流程。RFdiffusion 生成覆盖 MHC-I 肽段结合槽上方空间的新型骨架结构,优先接触疾病肽段的暴露残基;ProteinMPNN 进一步优化氨基酸序列,确保结构稳定并增强结合能力;AlphaFold2 和 AlphaFold3 则用于预测并筛选高置信度的特异性结合构象。在此基础上,设计策略强调减少与 MHC 保守区域的非特异性接触,并引入空间阻隔残基,显著提升靶向识别的专一性。
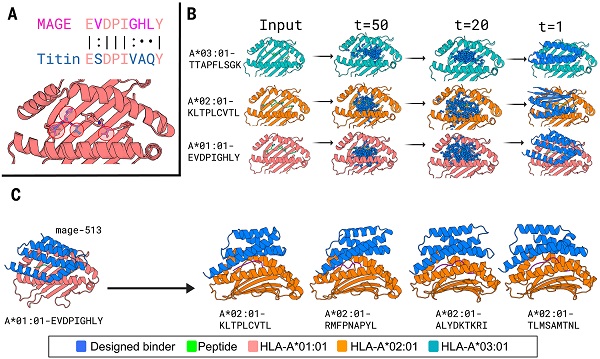
图 | RFdiffusion 生成 pMHC 结合蛋白的设计流程
并且,设计策略采用双轨并行:一方面,研究团队针对 11 个独立靶点,从头设计生成全新骨架的结合蛋白;另一方面,基于已成功设计出的 ALHGGWTTK/A*03:01 结合蛋白骨架,通过 Partial Diffusion 技术对其进行适配,迅速扩展至 MAGE-A3、gp100 等新靶点,使得新靶点的开发周期缩短至一周以内。
研究团队设计了 11 种具有代表性的结合蛋白,覆盖 SARS-CoV-1、HIV、YFV 等病毒肽段,WT1、gp100、MART-1、PRAME 等肿瘤相关抗原,以及 CTNNb1 S5F 等突变新抗原。这些蛋白经多项实验验证其设计效果。研究团队通过酵母展示与 FACS 筛选,证实其能选择性结合目标 pMHC 复合物,且不与相似脱靶肽段发生非特异性结合,体现出良好的特异性。结构解析结果也表明,设计蛋白在结合模式上与预测模型高度一致,并展示出稳定的关键相互作用。部分结合蛋白中还通过引入空间阻隔残基进一步提升识别选择性,验证了这一策略的有效性。整体数据从功能活性到结构一致性多维度支持了 AI 辅助蛋白设计平台的准确性与可靠性。
尤为重要的是,这些结合蛋白被整合进嵌合抗原受体(CAR) 中,并表达在 Jurkat T 细胞(一种人 T 细胞系)表面后,展现出特异性激活效应。在近似生理条件下,仅在加载目标肽段的靶细胞刺激下,T 细胞标志物 CD69 显著上调,而对其他非靶肽段无明显反应。此外,一些设计蛋白成功区分了单一突变引起的肽段差异,进一步强调了其识别的精细程度。
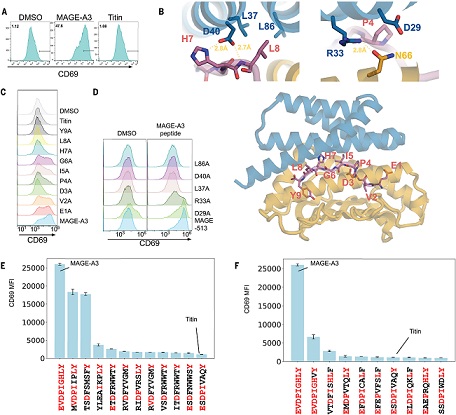
图 | AI 设计蛋白在 CAR-T 细胞中的特异性激活验证
PRAME 的案例尤具代表性。尽管缺乏已解析的 pMHC 复合物结构,研究团队借助 AlphaFold3 预测其与 HLA-A*02:01 结合构象,基于预测模型成功设计出两个高亲和力结合蛋白,并证实其在 CAR-T 细胞中具有显著杀伤活性。这一成果表明,该平台不仅适用于已有结构数据的靶点,也可用于结构信息缺乏的潜在抗原。
该研究为实现广泛适用的个性化免疫治疗提供了关键工具。通过快速设计靶向 pMHC 的高特异性结合蛋白,不仅能拓展 CAR-T 细胞治疗的靶点范围,也为开发双特异性 T 细胞衔接器等免疫分子提供基础。其通用性与扩展性意味着未来可针对每位患者的 HLA 型与疾病特异抗原,在短时间内构建“量身定制”的分子识别系统,极大提升免疫治疗的普适性与安全性。
目前该团队已提交临时专利申请,并计划推动平台商业化落地与临床转化。结合蛋白设计的标准化流程、验证机制与结构预测框架共同构成了一个高度可拓展的工程平台,有望加速高特异性免疫分子的开发步伐,推动下一代精准免疫疗法走向现实。
参考链接:
1.Bingxu Liu et al.,Design of high-specificity binders for peptide–MHC-I complexes. Science 389,386-391(2025). DOI:10.1126/science.adv0185
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有