2024 年 5 月,Summit Therapeutics宣布,其双特异性抗体新药依沃西单抗注射液在头对头临床试验中击败了默沙东的重磅疗法 Keytruda,后者是一款年销售额近 300 亿美元的抗肿瘤药物。依沃西单抗注射液是 Summit 于 2022 年从康方生物获得该药物在美国、加拿大、欧洲及日本的开发及商业化的权益授权。
仅靠一款来自中国药企授权、还未上市的创新药,就让 Summit 在过去一年内市值大涨,使其在无任何商业化药物的情况下仍跃居生物技术行业的上层。
在 Summit 公布数据不久后,默沙东效仿其双靶点抗体策略,从上海礼新医药引进了 PD-1/VEGF 双特异性抗体。
就像 DeepSeek 以低成本、高性能开源模型火爆出圈、挑战 AI 巨头一样,中国创新药企也正在用类似路径重塑全球医药创新格局:用更低的成本,创造相同甚至更好的创新成果。
美国《华尔街日报》也不禁感叹,中国生物制药行业正在迎来“DeepSeek 时刻”。


从制造中心转向创新中心
过去十年,中国的创新正在稳步提升,并已开始颠覆美国的药物开发生态系统。从加速药品审批的监管改革到对细胞和基因疗法等尖端技术的投资等。如今,中国贡献了全球创新药物管线的 23%,并在生物制剂、精准医疗和合成生物学方面引领多项进步。中国创新药行业快速发展,其正在从制造中心转向创新中心。
2024 年 5 月,国家药监局药品审评中心(CDE)发布《中国新药注册临床试验进展年度报告(2023 年)》(以下简称《报告》)。《报告》显示,2023 年,药物临床试验登记与信息公示平台登记临床试验总量首次突破 4000 项,达 4300 项(以临床试验登记号计算),为历年登记总量最高。
此外,随着中国研发水平日益国际化,中国医药创新能力逐步获得全球认可,许可交易数量屡创新高。根据 DealForma 的数据,2020 年,在预付金额达 5000 万美元或以上的大型医药交易中,中国药企占比不到 5%,2024 年,这一数字飙升至近 30%,预计十年后,许多进入美国市场的药物将源自中国实验室。
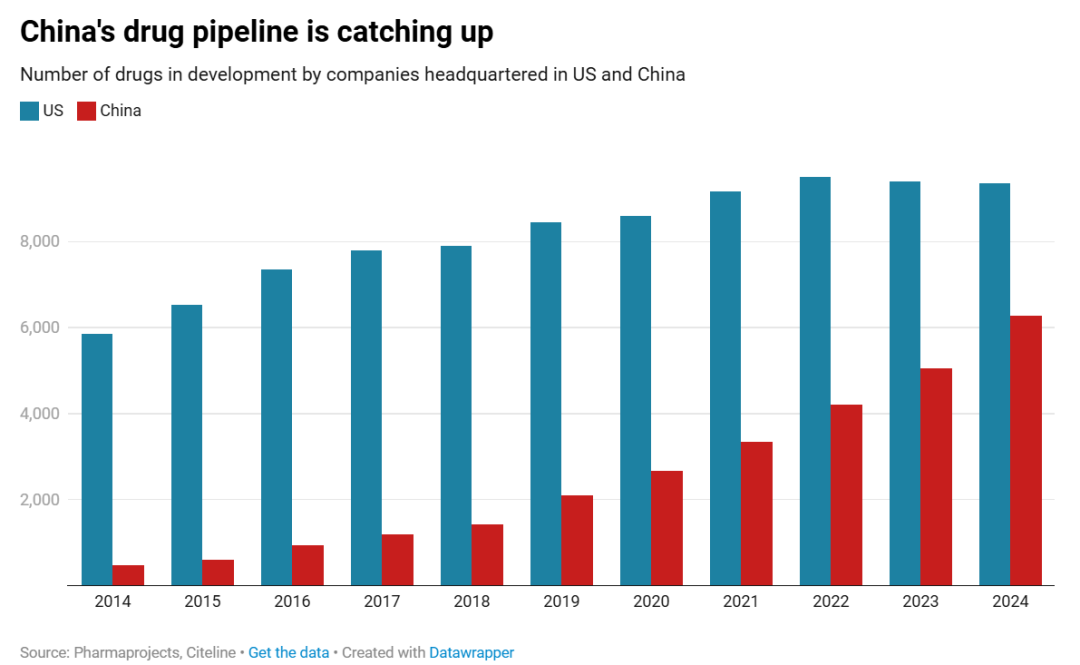
图 | 中国正在研发中的药物
根据公开数据,2024 年,中国药企创新药出海交易事件超过 100 个,大约是 2020 年出海数量的 4 倍,出海授权数量首次超过从海外引进。产品以生物药物为主,但不再只是 ADC 产品火爆,还包括单抗、TCE 双抗/三抗、融合蛋白和疫苗;出海地区也不再仅限于美国。
如在肥胖症药物市场,礼来和诺和诺德分别凭借 GLP-1 药物 Wegovy 和 Zepbound 主导市场,默沙东和阿斯利康选择从中国获取早期口服疗法授权:前者以 1.12 亿美元预付款和 19 亿美元潜在里程碑付款,从翰森制药获得口服 GLP-1 药物;阿斯利康以 1.85 亿美元预付款和 18.25 亿美元潜在付款,与诚益生物合作开发 GLP-1 受体激动剂(GLP-1RA)ECC5004,用于包括肥胖症、2 型糖尿病和其他合并症的潜在治疗。
其中,NewCo 模式交易也日渐兴起。NewCo 模式的核心在于通过设立海外新公司,将创新药的海外权益授权给该新公司,并引入海外资本和国际化管理团队,从而实现产品出海,并获得一定的资金和股权。
仅 2025 年伊始,中国创新药界就开启了多个 NewCo 交易。映恩生物、先为达、康诺亚、和铂医药、科伦博泰等企业进行了 NewCo 交易,总金额超 40 亿美元。
许多跨国药企多年来一直在中国市场深耕细作,部分跨国药企来自中国市场的收入占比不断上升,中国市场营业收入增速甚至高于全球市场。随着中国创新研发软实力的提升,以及市场竞争加剧。这些大型药企也开始探索符合中国市场规律的新战略。如百时美施贵宝在 2020 年提出“中国 2030 战略”;辉瑞在 2024 年 11 月承诺在华投资 10 亿美元推动创新,瞄准中国市场;赛诺菲、百时美施贵宝、罗氏等大型药企均明确向外释放“寻找中国并购机会”的意愿。

人才、政策、成本优势推动产业繁荣发展
那么,中国生物技术的繁荣是如何发展起来的?
人才积累。近年来,国内生物医药领域吸引了大量海外高层次人才回国创业或加入本土企业,推动了中国创新药研发与国际标准的接轨;国内高校在基础研究领域持续突破,与企业合作建立联合实验室或转化平台;此外,得益于庞大的患者基数与高效的临床试验管理能力,中国临床研究效率显著高于海外。
政策红利。自 2015 年药审改革以来,国家药监局(NMPA)通过优化 IND(临床试验申请)流程、引入 ICH 国际标准等措施,大幅缩短创新药上市周期。2024 年新增试点政策(如临床试验申请 30 天审结、分段生产试点),进一步降低企业研发的时间成本;药品上市许可持有人(MAH)制度允许研发机构独立持有药品上市许可,促进资源向创新型企业倾斜;此外,浦东新区等政策试点允许创新药参照国际定价,增强企业研发回报预期;监管机构还降低了仿制药的价格,以激励创新药的开发。
2024 年 9 月,国家药品监督管理局的相关负责人就介绍,药品监管部门正按照全会部署谋划全面深化药品监管改革的一揽子政策措施,着力打造具有全球竞争力的医药创新生态。
成本优势。研发成本全球洼地,中国临床试验成本仅为欧美 30%-50%,患者招募效率高(如肺癌患者数量超全球 1/3)。药明康德等 CXO 企业提供“一站式”服务,降低药企研发投入风险;产业链高度成熟,原料药(中国占全球产能 40%)、CRO(市场规模超 1000 亿元)、CDMO(药明生物全球市占率超 10%)形成完整生态。苏州、上海、杭州、深圳等地打造产业园区,促进合作并加强产业能力,降低研发成本。
此外,随着越来越多的制药商重视并利用人工智能,AI 的算法和计算能力赋予了生物医药研究前所未有的速度和精度,正在推动生物医药进入一个高效、个性化和革命性的新时代。

(来源:Pixabay)
2025 年初,在旧金山举办的第 43 届摩根大通医疗保健会议(JPM)上,中国生物科技公司的崛起已成为一个主要话题。随着中国生物技术产业的发展,中国公司已有能力在肥胖症、癌症和其他生物技术领域展开竞争。
Meliora Therapeutics 的首席执行官 David Li 就曾在参加 JPM 前在推特分享,公司在探索针对癌症治疗的哪些生物途径时,几乎每个领域都有中国竞争对手;在上海和苏州的实地考察更是让他刮目相看。
总而言之,随着人才、政策、成本等方面的持续优化,中国正从“仿制跟随”转向“全球创新”,有望成为全球创新药的核心参与者。
正如 Summit 的首席执行官 Robert Duggan 所言:“若你寻求创新,中国已成为必争之地。”
参考链接:
1.https://pharmaboardroom.com/articles/strengthening-international-cooperation-stimulating-new-momentum-for-the-growth-of-chinas-pharmaceutical-industry/
2.https://www.ydcdei.org.cn/news/show/989938623006912512
3.https://itif.org/publications/2024/07/30/how-innovative-is-china-in-biotechnology/
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有