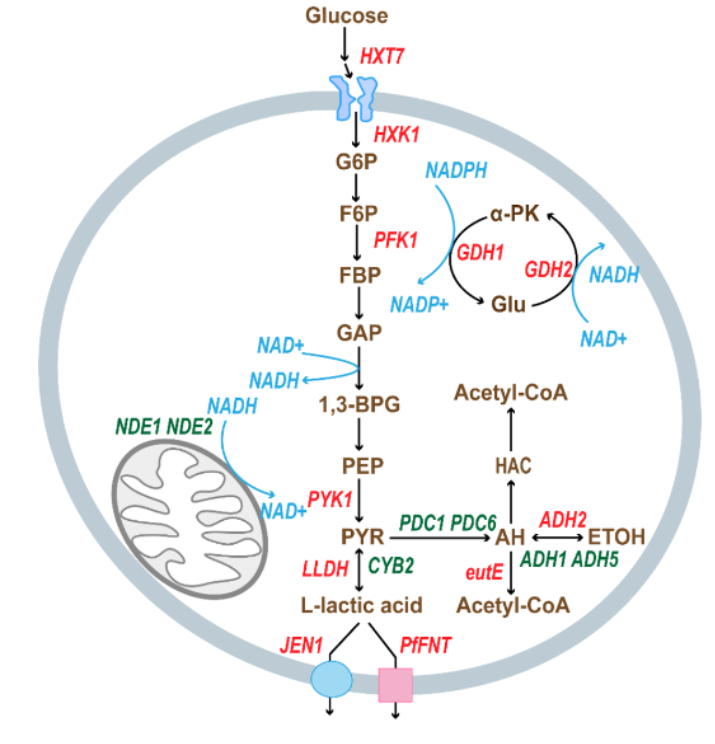
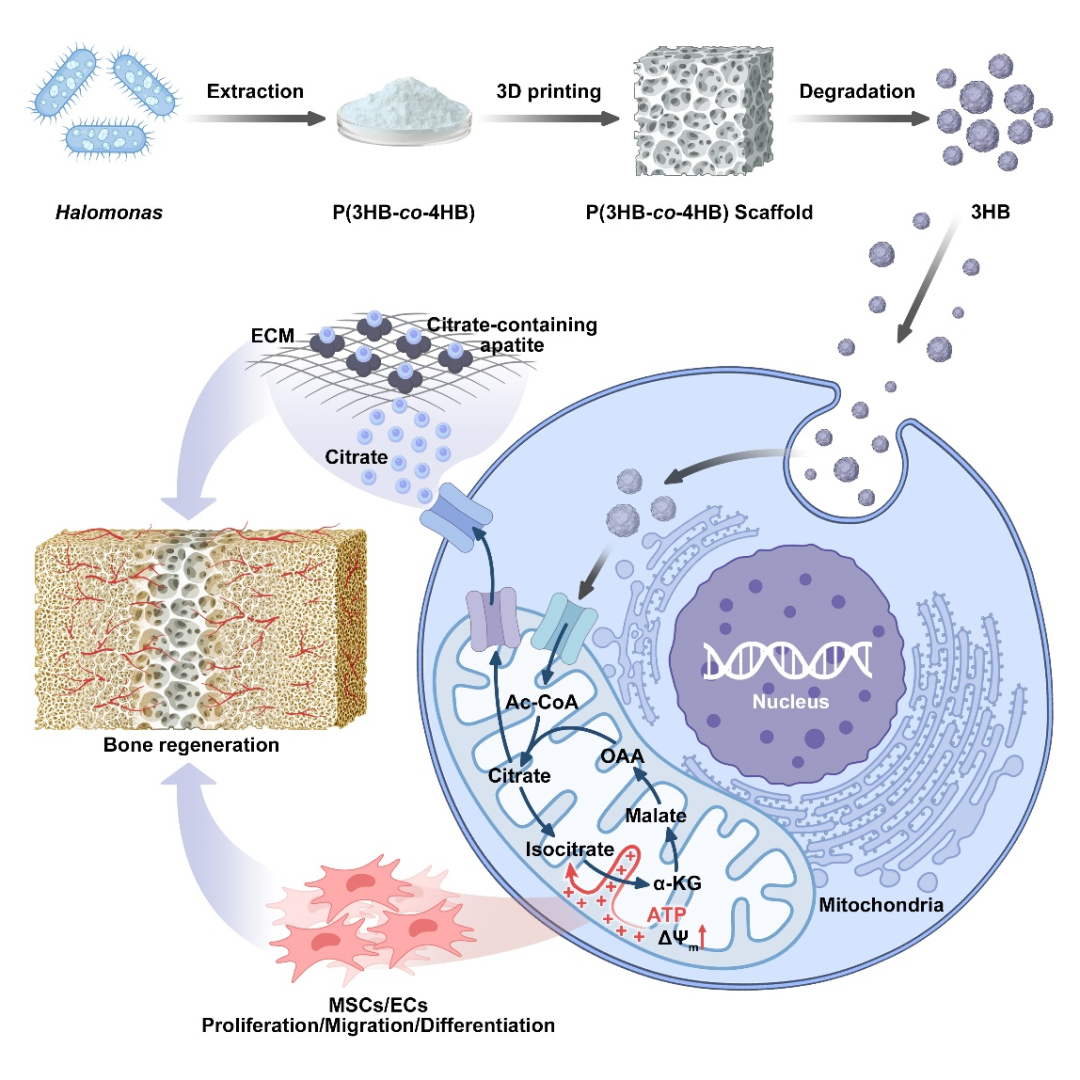
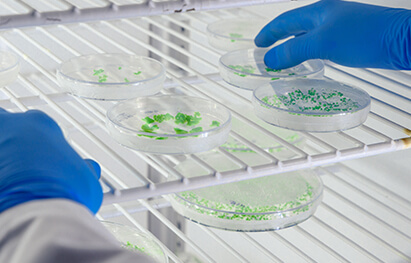
癌症免疫治疗的主要挑战之一在于,大量肿瘤呈现出“冷肿瘤”特征,即缺乏足够的免疫识别信号,从而逃避免疫系统的监测与攻击。促使此类肿瘤“转热”的关键策略之一,是通过抗原呈递过程诱导其表达免疫激活信号,以增强肿瘤细胞对机体免疫系统的可识别性与应答性。
近日,谷歌 DeepMind 与耶鲁大学合作,正式发布了 Cell2Sentence-Scale 27B(简称 C2S-Scale) —— 一款拥有 270 亿参数、旨在理解单个细胞语言的基础模型。该模型基于谷歌开源的 Gemma 系列模型构建,代表着单细胞分析领域的全新前沿。
这项成果就聚焦癌症免疫治疗的挑战:如何让所谓的“冷肿瘤”(对免疫系统隐形的肿瘤)变“热”,从而更易被免疫系统识别并响应治疗。
DeepMind 称,其模型能够“生成关于癌细胞行为的全新假设,并且已通过活细胞实验验证了其预测。此外,该模型成功预测一种能够积极增强免疫信号的药物,这种药物只能在特定的生物环境下增强免疫可见性。
谷歌首席执行官 Sundar Pichai 在社交媒体上写道:“随着更多的临床前和临床测试,这一发现或许能揭示出一种开发抗癌疗法的全新途径。”
该模型及相关工具已在 Hugging Face 和 GitHub 上公开,相关科研预印本已发布在 bioRxiv 上。
图 | “冷”肿瘤细胞几乎不被免疫系统识别,而“热”肿瘤细胞表面抗原丰富,更易被攻击
为了找到能够积极增强免疫信号的药物。研究人员让 C2S-Scale 分析了患者的肿瘤数据,并模拟了 4000 多种候选药物在两种条件下的效果:一种情况下免疫信号活跃,向模型提供来自真实患者样本的数据,包含完整的肿瘤-免疫相互作用及低水平干扰素信号;另一种情况下免疫信号不活跃,提供无免疫背景的细胞系数据。要求模型预测哪些药物仅在免疫活跃环境中能提升抗原呈递,以便更接近临床实际场景。
模型筛选出的药物中,大约有 10% 至 30% 已在文献中被报道,其余则是从未被提及的新发现。其中,激酶 CK2 抑制剂 Silmitasertib(又名 CX-4945)可显著提升抗原呈递。当 Silmitasertib 作用于免疫活跃环境时,抗原呈递显著增强;而在免疫中性环境中则几乎无效。
在人类神经内分泌细胞模型中进行测试,支持了模型的预测:单独使用 Silmitasertib 对抗原呈递无影响;单独使用低剂量干扰素可轻微提升抗原呈递。联合使用 Silmitasertib + 低剂量干扰素,抗原呈递水平上升约50%,显著增强肿瘤细胞被免疫系统识别的可见性。
令人兴奋的是,这一预测在科学文献中从未被报道。虽然 CK2 已知参与多种细胞功能,并被认为可能调节免疫系统,但此前并无研究显示通过 Silmitasertib 抑制 CK2 可以显著提升 MHC-I 表达或抗原呈递。
这意味着,模型真正提出了一个全新且可验证的科学假说,而非简单重复已知事实。
值得注意的是,上述预测结果已在实验室中被多次验证。C2S-Scale 成功发现了一种干扰素依赖型放大剂,揭示了一条让“冷肿瘤”变“热”的潜在新通路,或将提高免疫疗法的应答率。
这一成果有望为未来的生物学发现提供了新方法。它证明了,遵循“规模定律”并构建更大型的模型(如 C2S-Scale 27B),可以创建足够强大的细胞行为预测模型,用于:高通量虚拟药物筛选;识别“环境依赖型”生物学规律;生成具有生物学依据的实验假设。
目前,耶鲁大学的研究团队正在深入研究这一免疫效应的分子机制,并验证模型生成的其他预测。随着更多临床前与临床验证的推进,这类 AI 生成假说有望加速新疗法的发现进程。
参考链接:
1.https://blog.google/technology/ai/google-gemma-ai-cancer-therapy-discovery/ 2.https://www.biorxiv.org/content/10.1101/2025.04.14.648850v2 免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有