近年来,随着代谢工程和合成生物学的快速发展,微生物细胞工厂(Microbial Cell Factories, MCF)已成为从可再生原料中高效生产化学品的重要平台。鉴于开发高效的微生物细胞工厂面临着复杂的技术挑战和高昂的成本,人们开始尝试通过计算生物学方法预测微生物细胞工厂高产所需的代谢工程改造靶点,以减少试错成本。然而,现有的方法往往只能提供大量的候选基因靶点,缺乏对代谢网络中酶活性和资源分配的综合考虑,这使得实验验证过程繁琐且效率低下。
在此背景下,上海交通大学鲁洪中课题组联合查尔姆斯理工大学、西北农林科技大学、中科院大连化学物理研究所等机构的研究人员联合开发了一种细胞工厂设计新工具——ecFactory,该工具基于酶约束代谢模型(ecModel),可以预测提升不同种类化学品合成效率所需的代谢工程改造目标,并分析不同化合物间共有的基因改造靶点,为开发多功能平台菌株指明了方向。同时,利用 ecModel,研究人员系统预测了酿酒酵母(Saccharomyces cerevisiae)中 103 种高价值化学品的代谢工程改造基因靶点及其最佳组合,助力酵母细胞工厂的全局优化研究。相关工作于近期发表于 PNAS。
这项工作中,为系统开展细胞工厂的理性设计,作者首先收集了酿酒酵母中可以合成的 103 种具有工业价值的化学品。根据化学特性,103 种化学品被分为 10 个家族,包括氨基酸、萜类化合物、有机酸等(图 1)。对于其中相对于酵母底盘的 53 种异源产品,作者系统收集其合成所需的异源反应和酶动力学数据,并将其整合到酵母的酶约束代谢模型(ecYeastGEM v8.3.4,后文简称为 ecModel)中。随后,通过通量平衡分析(FBA)模拟,评估了酵母在不同葡萄糖消耗率(1 mmol/gDW/h 和 10 mmol/gDw/h)下的最大生产潜力。与经典的基因组尺度代谢网络模型(GEMs)相比,ecModel 具备的额外约束条件——酶量和酶动力学约束。结果表明,在 ecModel 中,由于酶约束的存在,产品合成和菌株生长之间不再是简单的标准线性权衡(图 1),最大产品合成速率受酶资源总量和关键酶动力学参数的限制。

图 1 | A)用于计算预测的 103 种化学物质的化学分类。B)传统代谢模型与酶约束代谢模型生产-生长相平面图
具体而言,通过模拟,作者发现在低葡萄糖消耗速率条件下,40 种异源产品合成被识别受蛋白资源高度限制,此类产品主要集中在异源代谢物中,如萜烯和黄酮类化合物(来自甲羟戊酸途径)(图 2)。而来自天然生物合成途径相关的(如氨基酸、有机酸和一些醇类)化合物合成受蛋白资源限制较小。相比于传统 GEMs,ecModel 提供了从产物合成所需的底物成本和酶量成本两方面考虑化学品合成所需投入的成本和资源。结果显示,两种生产成本之间存在正相关,且分子量较大的化学品更容易受到蛋白资源限制。基于此分析,可将 103 种化合物大致分为高度酶约束和轻度酶约束的两种组别(图 2),两种酶约束模式也暗示了两类化合物不同的产量提升策略。

图 2 | A)103 种化合物生产受蛋白资源约束情况。B)各类别产物-底物成本和产物-所需酶量成本对应关系
在上述分析的基础上,研究人员基于 ecModel 的优良预测性能,开发了指导细胞工厂系统级优化的计算工具包 ecFactory,以克服现有细胞工厂设计算法在筛选代谢工程靶点方面存在预测精度不高、组合靶点选择困难等关键瓶颈。ecFactory 通过三个步骤进行代谢工程目标的预测(图 3)。首先,利用已有强制目标函数的通量扫描算法(FSEOF)预测基因表达分数,确定目标基因改造策略,如基因表达强化、弱化与基因敲除。其次,根据酶的催化效率和连接性,对基因靶点进行分类,剔除编码冗或低效的基因靶点。最后,确定从最优生物量形成模式转变为生产模式所需的最小基因靶点改造组合。该计算工具的输入模型采用标准的 SBML 格式,因此现有的来自其他物种的标准格式模型也可直接应用 ecFactory 进行计算。
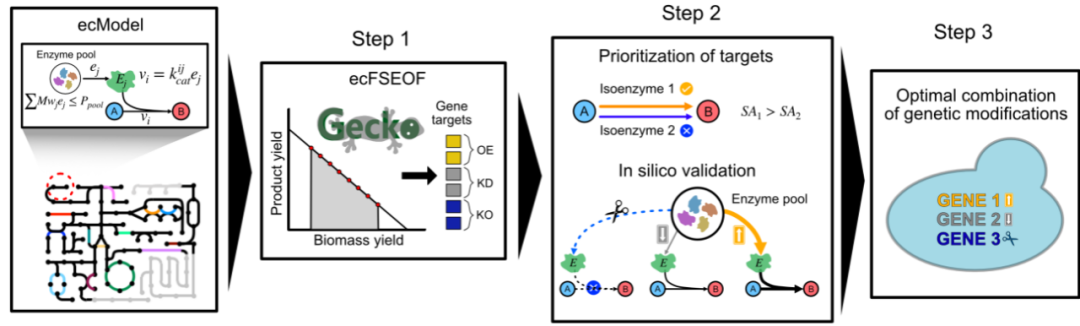
图 3 | ecFactory 计算流程
通过整合酶约束,ecFactory 显著减少了需测试的基因靶点数量,提高了预测的准确性和实用性。在第一步中,FSEOF 平均预测了 85 个基因靶点(28 个过表达、42 个敲低和 15 个敲除),而经过 ecFactory 筛选后,最终每种产品平均剩余 7 个过表达、9 个敲低和 5 个敲除目标(图 4)。汇总 103 种化合物的预测基因靶点发现,酵母中的 150 个内源基因被预测为至少一个化学品对应的的基因强化靶点;88 个不同的基因被预测为基因弱化靶点,129个被预测为基因敲除靶点。超过 50% 的基因强化、弱化和敲除靶点与 103 种产品中的一种或两种相关(图 4)。其中一小组基因被预测为大量产物高产所需的共同目标(也被称为高频繁目标),这些产物几乎来自所有化学分类。

图 4 | 提高酵母 103 种化学物质产量所需的基因改造靶点预测
进一步,研究人员对 ecFactory 算法的预测效果进行了系统评估。结果显示,ecFactory 的预测结果与已报道的菌株改造策略显示出高度一致性。如在已报道的 2-苯乙醇代谢工程改造案例中,ecFactory 预测的 12 个基因靶点中,有 7 个(过表达靶点:ARO2、PHA2、ARO10、ARO1、ARO4、ARO7 和 ZWF1)与实验结果一致。对于亚精胺的高效合成,ecFactory 预测到 9 个(过表达靶点:SPE1、SPE2、SPE3、MEU1、ORT1、AGC1 和 GDH1;敲除/敲降靶点:CAR2 和 SPE4)与实验结果一致基因改造策略(图5)。此外,除了已被验证的靶点,ecFactory 还可以识别出一些新的基因靶点。此外,通过总结 18 种化合物的改造案例,结果显示 ecFactory 预测的靶点与已有的实验报道靶点存在大量重合,进一步验证了 ecFactory 预测的准确性。

图 5 | ecFactory 可用于预测代谢工程靶点,用于提高酵母合成亚精胺产量(实验数据来源于 Nature Catalysis 2021, 4: 498–509)
最后,基于 ecFactory 的预测结果,作者为开发能够生产多种化学品的平台菌株提供了理论基础。通过 t-distributed stochastic neighbor embedding(t-SNE)方法对 103 种化学品的基因靶点进行聚类分析,并将这些目标分为 8 个不同的簇。每个簇代表一组具有相似代谢工程策略的产品。例如,簇 1 和簇 2 主要包含高度受蛋白质约束的异源产品,这些产品需要通过减少呼吸作用的蛋白质负担,将资源重新分配给异源酶的表达,从而提高目标化学品的产量。簇 3 主要包含受底物可用性限制的萜烯类化合物,这些产品需要增加 NADPH 的供应来提高产量。通过这种基于模型的设计方法,研究者提出了针对不同簇的代谢重编程策略,为开发具有广泛应用的平台菌株提供了新的思路,有望加速从石油经济向生物经济的转型。
总的来说,这项研究表明 ecModels 作为微生物细胞工厂设计的基础模型具备巨大潜力。该研究开发的 ecFactory 工具充分利用了酶约束模型的优势,拥有灵活的靶点过滤策略,并对预测的基因靶点进行综合打分排序。此外,ecFactory 可以预测提高目标生物产品合成的最小靶点组合。因此 ecFactory 的推广使用有望显著降低细胞工厂开发成本,缩短开发周期,在未来绿色发展战略中发挥重要作用。
这项研究为生物制造领域提供了一种新的计算工具和策略,有望加速细胞工厂的理性改造和可持续升级。未来,随着更多非模式生物的酶约束代谢模型的开发和完善,ecFactory 有望在更广泛的生物体系中发挥作用,为可持续化学生产提供更多的解决方案。此外,研究团队还指出,尽管 ecFactory 在预测基因改造靶点方面取得了显著进展,但进一步的实验验证和模型优化仍然至关重要。例如,酶动力学参数的缺乏仍然是限制非模式生物模型开发的主要瓶颈。为此,研究团队建议结合深度学习和贝叶斯推断等先进技术,进一步完善酶约束代谢模型的构建和优化。
在上述论文中,上海交通大学生命科学技术学院鲁洪中副教授与查尔姆斯理工大学 Jens Nielsen 教授为论文的共同通讯作者。该工作获得中国国家重点研发计划(2022YFA0913000)、上海市浦江人才计划,以及国家自然科学基金(22208211 和 22378263)的资助。
鲁洪中课题组长期从事于高精度数字细胞模型构建,破译基因型-表型关系,解析生命运作规律;开发细胞工厂精准设计算法,实现 BT 和 IT 技术的深度结合,以期解决细胞代谢全局可预测、菌株理性改造等合成生物学领域的关键问题与挑战。相关成果以一作或通讯作者发表于 Nat. Commun.、PNAS、Mol. Syst. Biol.、Brief. Bioinform.、Metab. Eng. 和 Trends. Biotechnol. 等国际知名期刊。
参考文献
I. Domenzain, Y. Lu, H. Wang, J. Shi, H. Lu, & J. Nielsen, Computational biology predicts metabolic engineering targets for increased production of 103 valuable chemicals in yeast, Proc. Natl. Acad. Sci. U.S.A. 122 (9) e2417322122, https://doi.org/10.1073/pnas.2417322122 (2025).
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有