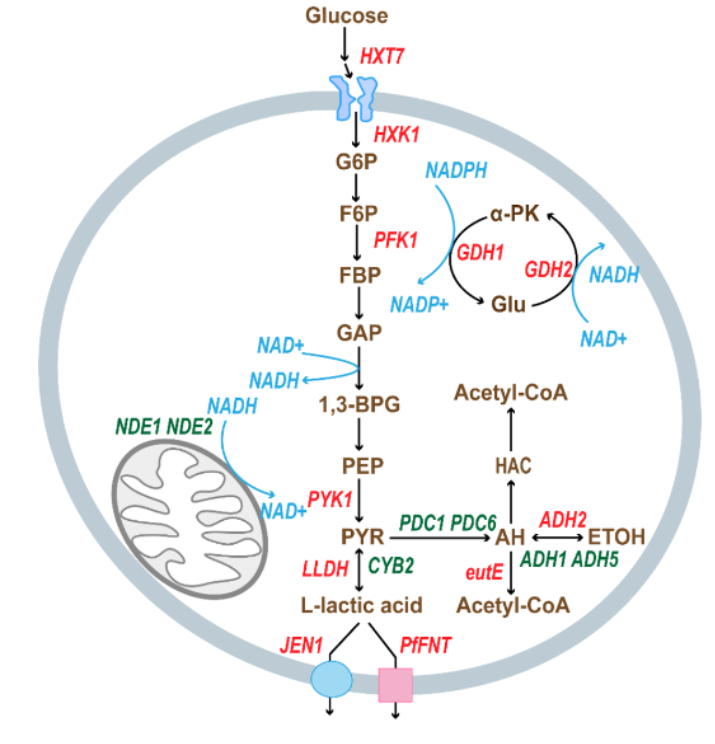
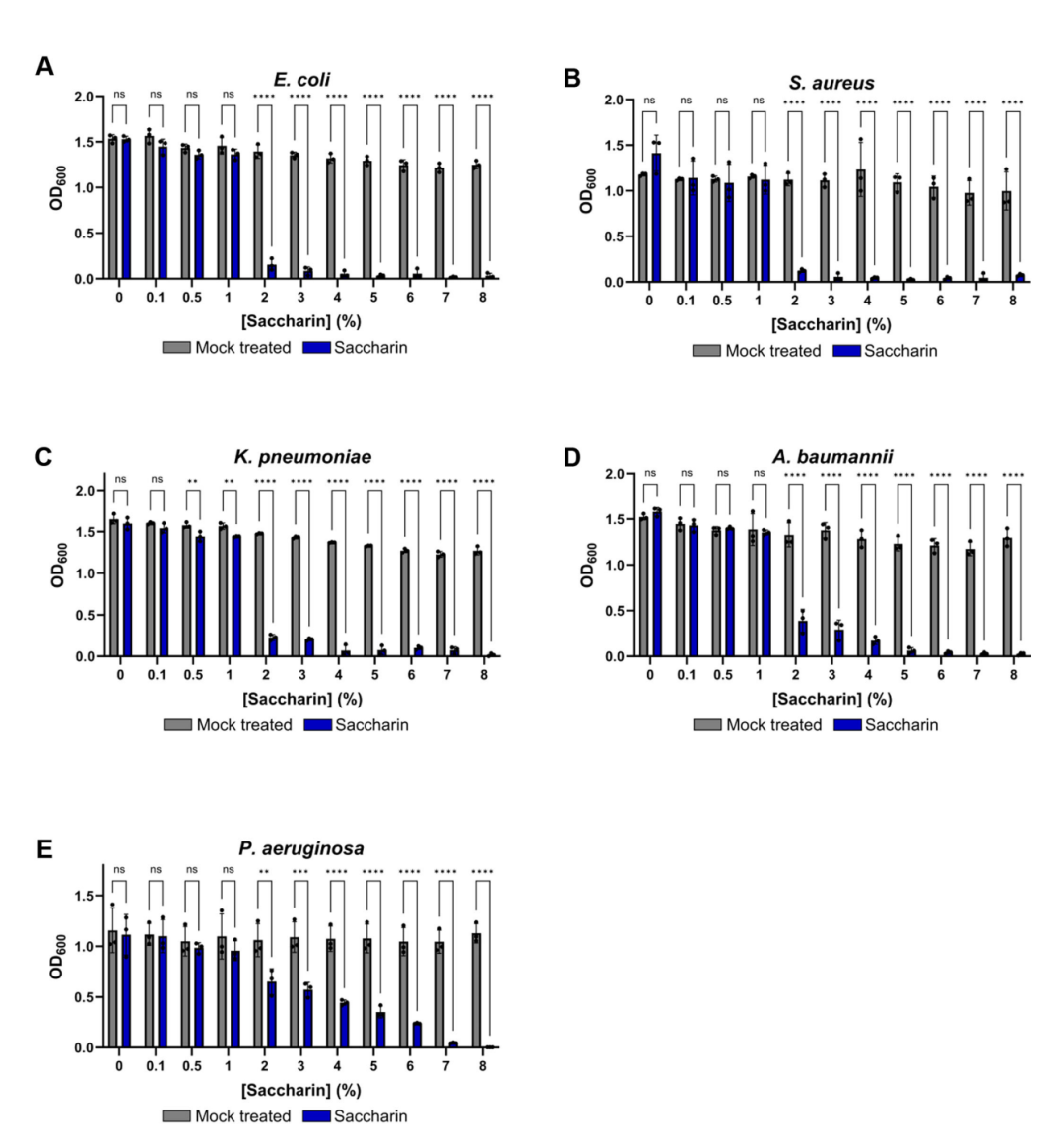
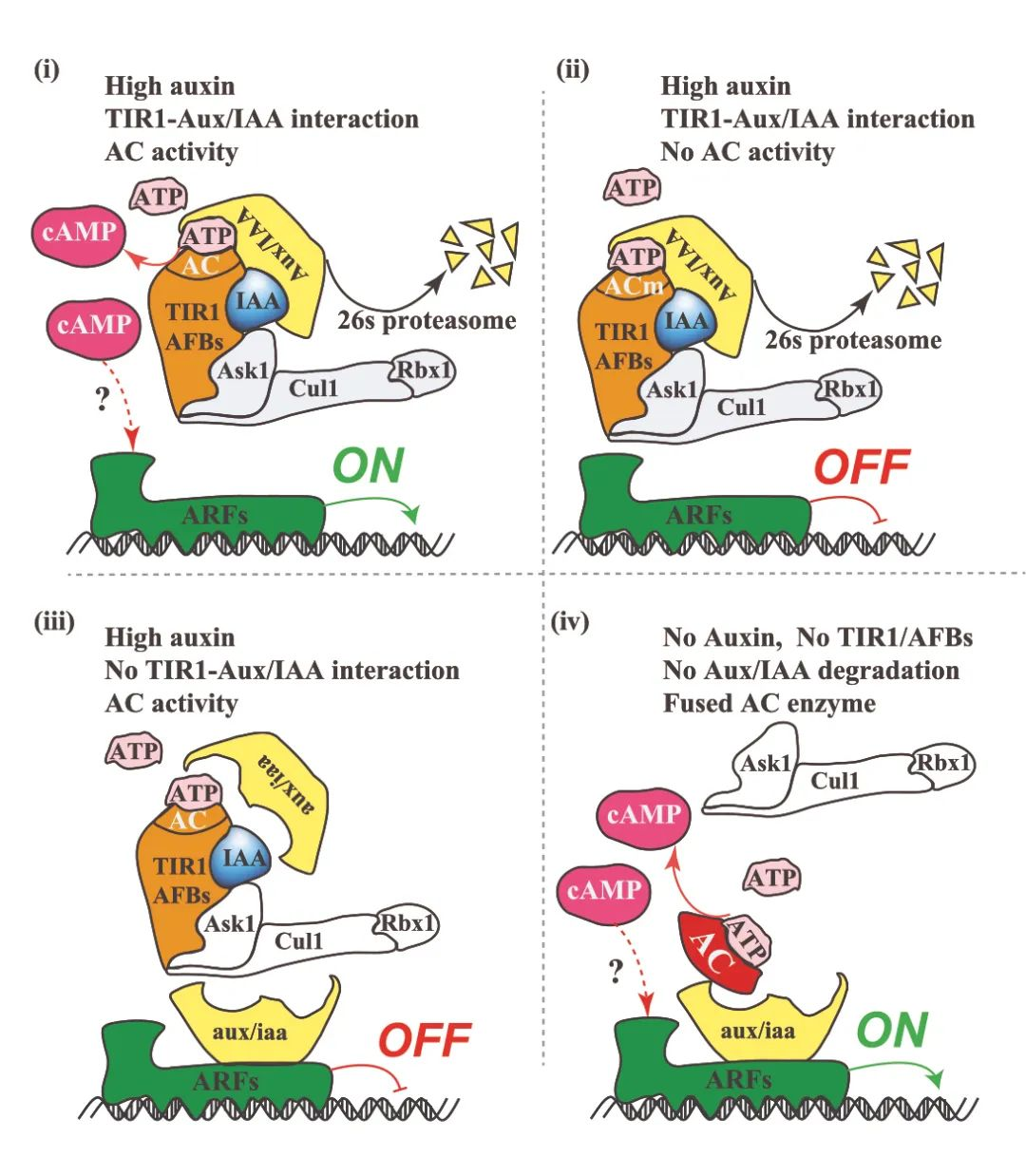
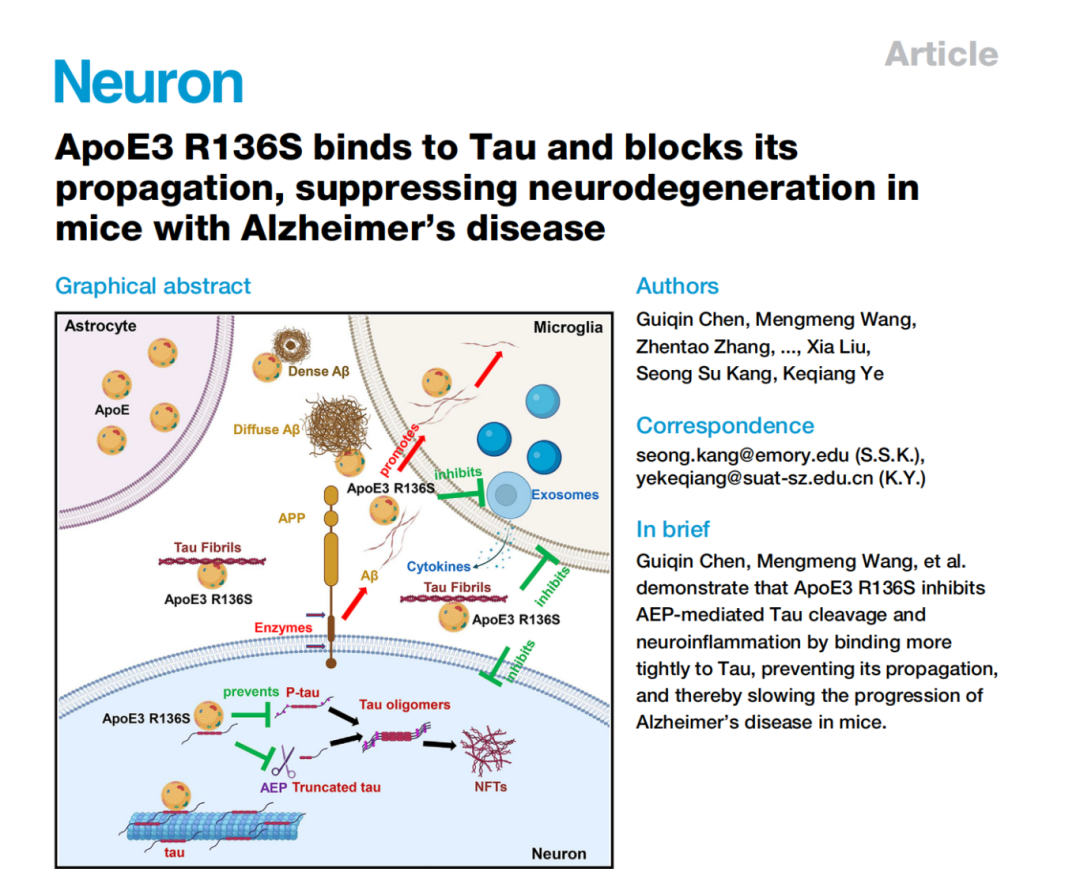
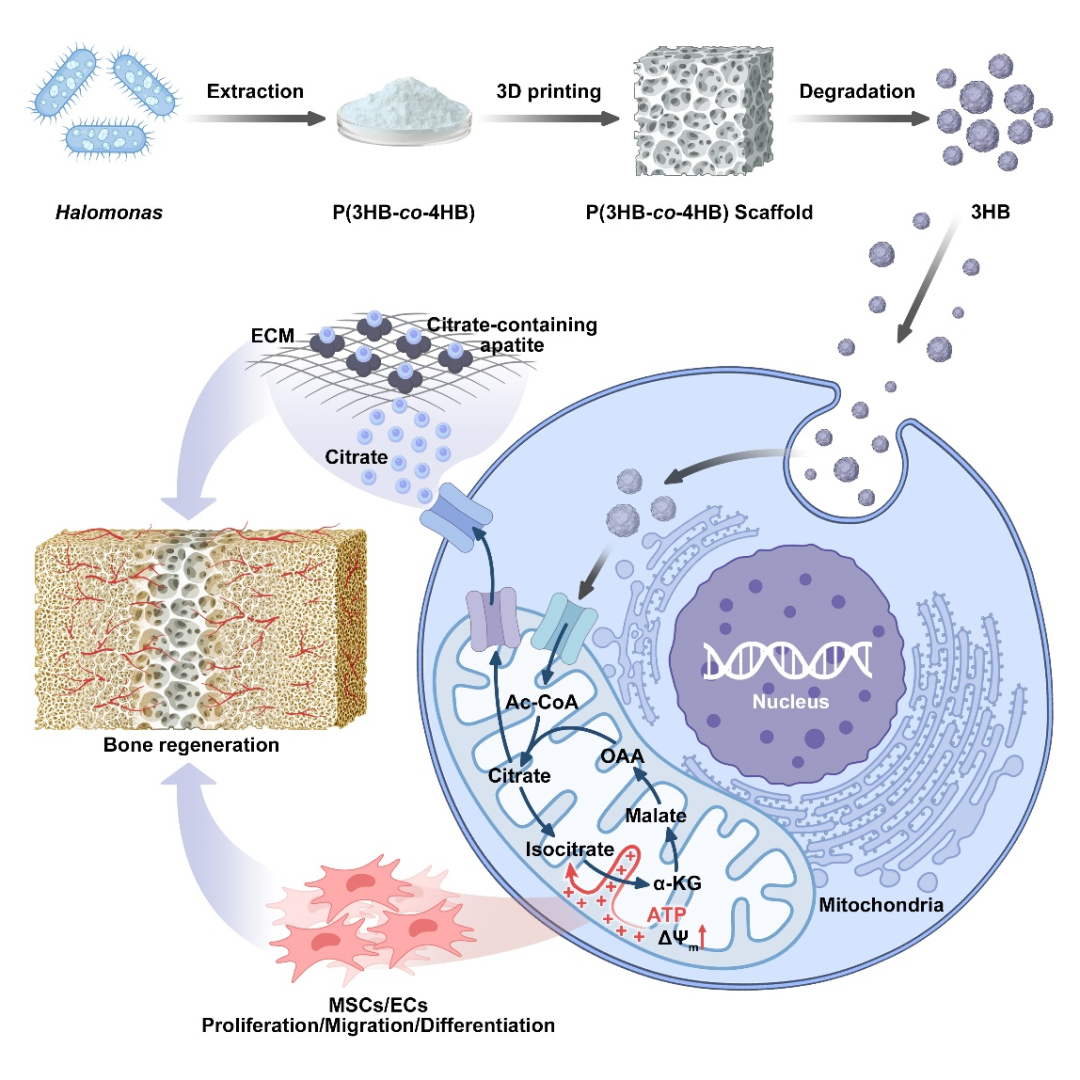
Mary E. Brunkow 出生于 1961 年,来自美国华盛顿州西雅图系统生物学研究所,其研究长期聚焦免疫疾病的遗传机制;Fred Ramsdell 出生于 1960 年,现任美国旧金山 Sonoma Biotherapeutics 公司科学顾问,致力于开发基于T细胞调控的免疫疗法;Shimon Sakaguchi 出生于 1951 年,现为大阪大学免疫学前沿研究中心特聘教授,被誉为“调节性T细胞之父”。 人体的免疫系统是一部精密的生物机器,每天都在识别和清除成千上万入侵的细菌、病毒与其他病原体。然而,这一强大的防御系统必须被精确调控,否则它也可能误伤自身,引发多种自身免疫疾病。 Brunkow、Ramsdell 与 Sakaguchi 的研究,正是揭示了免疫系统如何“自我克制”的关键机制。他们发现了调节性T细胞(Regulatory T Cells,简称Treg)这一“免疫系统的安全阀”——它们能够抑制过度活跃的免疫反应,防止免疫细胞攻击机体自身组织。这一发现为现代免疫学开辟了全新领域,并推动了一系列免疫治疗方法的诞生。 免疫系统的奇迹之一,是能够区分“自己”和“外来者”。T细胞是其中的核心角色,它们在体内巡逻,通过表面的“T细胞受体(TCR)”识别病毒感染细胞或异常肿瘤细胞。当发现威胁后,辅助性T细胞会发出信号,召唤免疫军团;杀伤性T细胞则直接摧毁被感染或突变的细胞。 问题在于——T 细胞的受体是通过基因随机组合产生的,这种组合方式理论上能生成超过 10¹⁵ 种不同的受体形态。这种庞大的“多样性”虽然保证了免疫系统几乎能识别任何外来入侵者,但也不可避免地会产生部分 T 细胞错误地识别自身组织。 那么,人体如何避免这些“叛徒”发动攻击? 早在上世纪80年代,科学界认为,人体通过一种名为“中枢免疫耐受(central tolerance)”的机制来防止自我攻击。T细胞在胸腺中成熟时,会经历严格的筛选,凡是能识别自身蛋白的T细胞都会被清除。然而,这一机制并不完美——仍有部分“危险分子”漏网。 当时有学者提出,体内可能存在另一种“抑制性T细胞”,负责压制这些漏网之鱼,但由于早期实验数据存在争议,这一假说一度被主流科学界否定。直到来自日本的免疫学家 Shimon Sakaguchi 重新点燃了这条研究线索。 20世纪80年代初,Sakaguchi在日本名古屋的爱知癌症研究中心工作。他注意到一个颇为反常的实验结果:研究人员在新生小鼠身上切除胸腺后,原本预期这些小鼠的免疫系统会变弱,但事实相反——几天后,小鼠的免疫系统“暴走”,出现严重炎症和器官损伤,最终死于自身免疫反应。 Sakaguchi据此推测,胸腺中不仅产生攻击外敌的T细胞,也会生成一种“调节性”细胞,用于抑制免疫过度反应。通过一系列实验,他从健康小鼠中分离出带有特定标志分子的T细胞(CD4⁺、CD25⁺),并发现将这些细胞注入无胸腺小鼠后,可以有效防止自身免疫疾病的发生。 1995年,Sakaguchi在《免疫学杂志》(Journal of Immunology)发表论文,首次系统阐述了这种新型T细胞的存在,并命名为“调节性T细胞”。这项工作为免疫学开辟了新的分支领域——外周免疫耐受研究。 就在 Sakaguchi 发现调节性 T 细胞的同时,另一项看似无关的研究在美国悄然展开。上世纪 40 年代,美国田纳西州橡树岭实验室在辐射实验中意外培育出一批奇特的雄性小鼠:它们皮肤粗糙、脾脏肿大、寿命极短。这种突变小鼠被命名为“Scurfy小鼠”。 直到 1990 年代,美国华盛顿州 Bothell 的生物技术公司 Celltech Chiroscience 的两位科学家——Mary E. Brunkow与 Fred Ramsdell,重新研究这一小鼠模型。他们怀疑,这种遗传性免疫紊乱与人类某些罕见自身免疫疾病(如 IPEX 综合征)有关。于是,他们开始长达数年的“基因寻凶”工作。 在那是基因测序尚未普及的年代,Brunkow 与 Ramsdell 手动比对了数百万个碱基对,最终在X染色体上发现一个此前未知的突变基因——FOXP3。他们发现,这个基因突变会导致T细胞无法正常分化,从而引发免疫系统失控、自身组织被攻击。 2001 年,他们在《自然·遗传学》(Nature Genetics)发表论文,证实FOXP3 基因突变正是导致 Scurfy 小鼠死亡和人类 IPEX 综合征的元凶。与此同时,他们也意识到,这一基因或许正是 Sakaguchi 发现的“调节性T细胞”的关键控制因子。 两年后,Sakaguchi 与多家研究团队几乎同时在《科学》(Science)上发表成果,确认 FOXP3 基因是调节性 T 细胞分化与功能的核心转录因子。缺失 FOXP3 的 T 细胞无法形成稳定的免疫抑制作用,免疫系统因而失控。 这意味着,Brunkow 和 Ramsdell 揭示了“密码”,而 Sakaguchi 揭示了“细胞”——两条线索最终拼成了完整的图景:免疫系统的平衡依赖于调节性T细胞,而这些细胞的生成与维持由 FOXP3 基因精确控制。 这就是所谓的外周免疫耐受机制。它像一道防火墙,确保免疫系统在清除外来威胁后能及时“刹车”,避免误伤自身组织。 这项发现不仅改变了免疫学教科书,也推动了临床治疗的革新。 在癌症研究中,科学家发现肿瘤往往能“招募”大量调节性T细胞,从而形成一道“免疫防护墙”,阻止免疫系统攻击癌细胞。因此,研究者正尝试阻断Treg功能,以提升免疫治疗效果,使T细胞重新识别并清除肿瘤。 而在自身免疫疾病(如1型糖尿病、红斑狼疮、类风湿关节炎等)中,科学家则采取相反策略——增强 Treg 活性。通过注射低剂量白介素-2(IL-2)或体外扩增自体调节性T细胞并回输,来重建免疫平衡、缓解炎症。 在器官移植和干细胞移植领域,Treg 疗法也展现出潜力:它们有望减少排异反应、改善移植成功率。这一系列新疗法的临床试验正在全球多地推进。 从最初的怀疑到如今的主流理论,调节性T细胞和外周免疫耐受机制的发现,堪称免疫学史上的一次范式转变。 它不仅揭示了人体如何避免“自我攻击”,也为精准免疫调控提供了理论基础。 正如诺贝尔奖委员会在颁奖声明中所写:“Brunkow、Ramsdell与Sakaguchi 的发现,阐明了免疫系统如何在防御与自我保护之间取得平衡。他们为现代医学提供了理解免疫调节的核心框架,并为人类带来了治疗自身免疫病与癌症的新希望。”
参考链接:
1. https://www.nobelprize.org/prizes/medicine/2025/popular-information/
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有