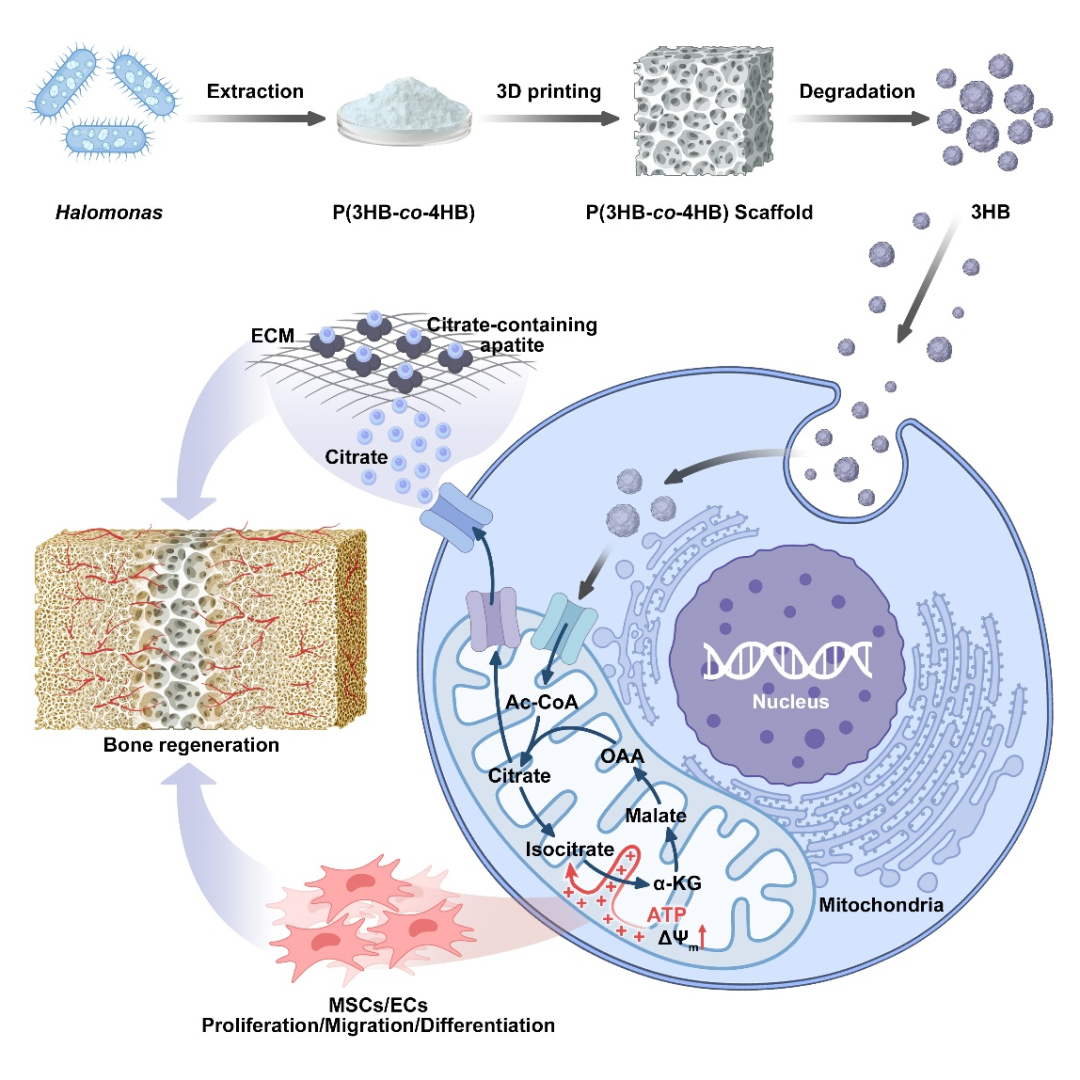
江南大学与中科院天津工业生物技术研究所团队在Nature Communications 发表了题为“Design and evolution of artificial enzyme with in-situ biosynthesized non-canonical amino acid”的研究,提出了一种将非经典氨基酸细胞内生物合成与遗传编码整合的策略,建立了一体化的人工酶设计平台,并实现了高效的不对称催化。该方法不仅提高了酶的产量和选择性,还为未来人工酶的大规模应用奠定了基础。
研究团队设计的核心是一个三质粒系统,将非经典氨基酸的合成途径与蛋白装配体系引入大肠杆菌。首先,他们利用改造后的 CysM-NiSat4 酶,在细胞内以芳香族硫醇为底物合成 S-芳基半胱氨酸类非经典氨基酸。通过代谢工程手段优化了该合成途径,保证了非经典氨基酸在细胞内的高效生成。随后,正交翻译系统与蛋白支架 LmrR 共同作用,使合成得到的 S-(4-氨基苯基)-L-半胱氨酸能够被特定地引入到 LmrR 蛋白第 15 位点。实验结果表明,当在培养基中加入 4-巯基苯胺作为前体时,细胞能够在无需外源补充非经典氨基酸的条件下直接组装人工酶,最终得到的 SFC_V15pAPhC 产量显著提高。与外源添加方式相比,人工酶的产量提升近一倍,验证了这一策略的高效性与可行性。
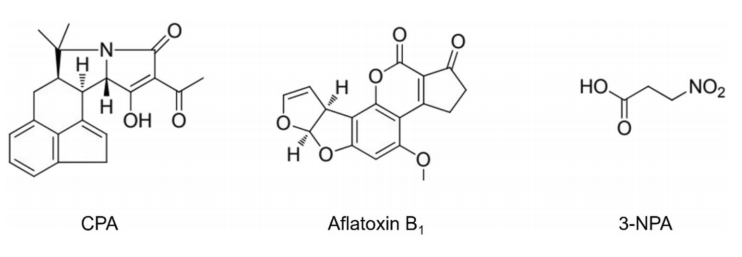
为了验证人工酶的催化性能,研究团队选择了不对称 Friedel-Crafts 烷基化反应作为模型反应。这一反应在有机合成和药物化学中具有重要价值,但天然酶极少能够催化。实验表明,SFC_V15pAPhC 能够在吲哚与烯醛的反应中催化生成相应的加成产物,并展现出 39% 的产率与 74% 的对映选择性。尤其值得注意的是,与此前报道的 LmrR_V15pAF 酶相比,该人工酶生成的产物具有相反的立体构型,说明在非经典氨基酸的官能团引入后,催化中心的空间排布和电子环境发生了显著改变。为了进一步确认催化活性来源,研究团队通过对照实验排除了 LmrR 本身的天然活性以及细胞背景代谢的干扰,证实催化活性完全依赖于引入的非经典氨基酸官能团。
在获得初步活性后,研究团队通过三轮定向进化对人工酶进行优化。他们首先对位于活性口袋周围的关键残基进行饱和突变,并筛选获得了多种在活性和选择性上有所提升的突变体。在第一轮和第二轮进化中,活性口袋形状的调整使得酶的催化效率逐渐提高,对映选择性从 74% 提升至 85% 左右。第三轮进化进一步优化了底物结合模式,使得最终获得的变体 SFC4.0 在Friedel-Crafts 反应中的对映选择性高达 95%,产率达到 98%,催化效率相比初始版本提升了 4.5 倍。这些成果表明,人工酶在经过有针对性的定向进化后,可以达到接近甚至超越传统化学催化剂的性能水平。
图 | 进化获得的人工酶 SFC4.0 的催化性能与底物适用性表征
在拓展底物范围的实验中,SFC4.0 不仅能够催化吲哚和烯醛的加成,还对取代吲哚和多种不同取代基的烯醛表现出较高的适用性,部分底物的对映选择性依然维持在 90% 以上。这表明该人工酶具有较强的底物普适性,为在合成化学中提供更广泛的应用可能。进一步的对比实验显示,SFC4.0 的催化效率已接近一些成熟的有机小分子催化剂,而其环境友好性和可扩展性则是化学方法所不具备的优势。
为了揭示人工酶独特手性选择性的来源,研究团队进行了分子动力学模拟。计算结果表明,氢键作用模式的差异是决定立体选择性的关键。在 LmrR_V15pAF 中,反应中间体更倾向与 D100 形成稳定氢键,使得底物从 Re 面进攻,生成(S)-构型产物。而在 SFC_V15pAPhC 中,中间体与 N88 结合更加稳定,导致底物从 Si 面进攻,从而生成(R)-构型产物。该研究不仅在实验上验证了立体化学差异,还通过理论计算给出了分子机制解释,为未来人工酶的理性设计提供了重要参考。
该研究的意义不仅在于获得了一种高效人工酶,更在于提出了一种通用的集成策略。通过将代谢工程与遗传密码子扩展相结合,研究人员建立了一个能够灵活引入多种非经典氨基酸并进行定向进化的细胞工厂平台。利用这一平台,只需更换不同的前体分子,即可快速构建含有多种官能团的人工酶库,从而拓展了人工酶的应用潜力。这一策略为催化新型非天然反应、开发绿色合成路径提供了可能,也为未来直接利用简单原料在细胞内构建杂合代谢通路奠定了基础。随着这一平台的推广,未来有望实现更多具有复杂化学功能的人工酶,为绿色化工、药物合成和可持续能源等领域提供关键工具。
参考链接:
1.Huang, W., Wang, S., Wei, Y.et al. Design and evolution of artificial enzyme with in-situ biosynthesized non-canonical amino acid. Nat Commun 16, 8698 (2025). https://doi.org/10.1038/s41467-025-63733-3
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有