在合成生物学领域,扩展遗传密码以实现非天然氨基酸的精确掺入一直是重要方向。这一策略能赋予蛋白质全新的化学结构和功能,为研究复杂生物过程及开发新型生物材料提供关键手段。然而,非天然氨基酸(ncAA)的细胞摄取长期受限。大多数 ncAA 难以穿越细胞膜,传统依赖被动扩散或天然氨基酸转运系统的方法效率极低,导致细胞内浓度不足、蛋白产量低,许多具有潜在功能的 ncAA 因此无法应用。
近期,苏黎世联邦理工学院 Kathrin Lang 教授团队在 Nature 发表了突破性研究,题目为“Hijacking a bacterial ABC transporter for genetic code expansion”,提出通过“劫持”细菌自身的寡肽转运系统 Opp,实现非天然氨基酸的主动递送。他们利用该系统的天然高亲和性底物识别机制,将 Opp 改造为可高效运送多类型ncAA的通用通道,从而显著提升了 GCE 体系的整体效率。这项工作突破了长期困扰遗传密码扩展技术的瓶颈,也为合成生物学的分子递送问题提供了可复制的解决思路。
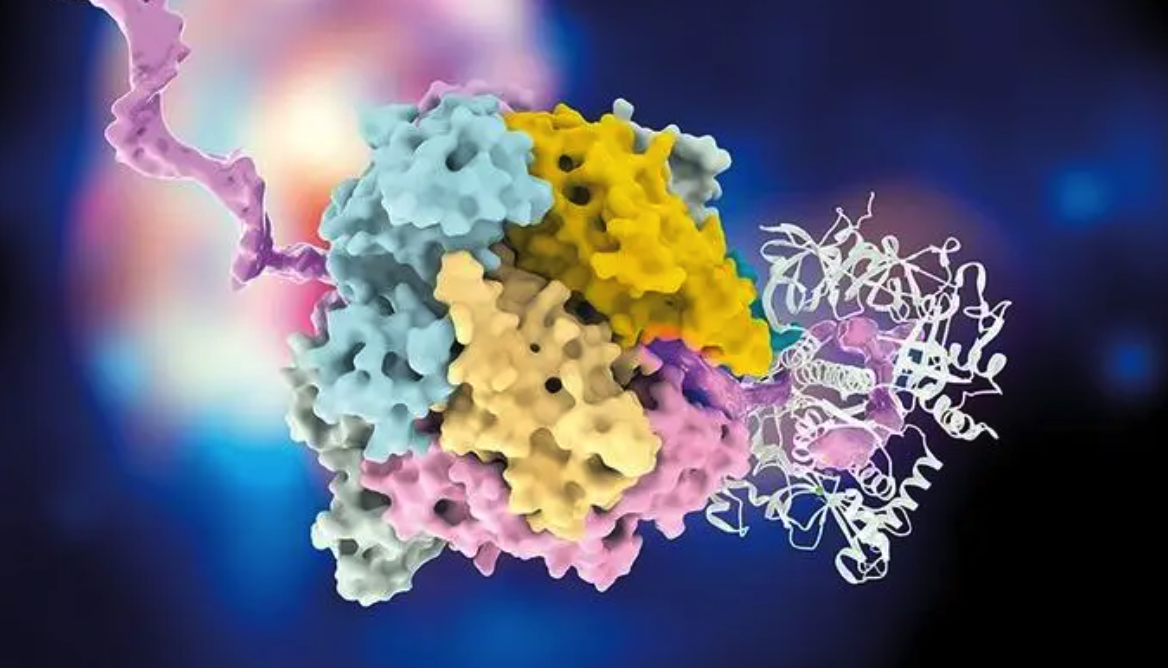
研究的核心设计是“异肽连接三肽”(Z-XisoK),其中 XisoK 是目标ncAA,而 Z 为 N 端残基。与早期设想不同,真正决定被 Opp 识别的并非单一 Z 侧链,而是整个三肽骨架与末端结构。其 N 端 α-氨基与 OppA 的 D445 形成关键氢键,C 端羧基与 R439、H397、N392 构成配位网络,共同构成了被 Opp 系统识别的“通用通行证”。Z 位点则提供了一个可定制的“货物挂载点”,可容纳不同的侧链以实现多样化修饰。进入细胞后,肽酶 PepN 和 PepA 切割三肽,释放出游离的 XisoK,再被 PylRS/tRNA 体系识别并掺入蛋白。通过该策略,研究人员成功将难以直接透膜的 AisoK以G-AisoK 形式高效递送,其蛋白表达水平与天然氨基酸体系相当。
图 | OppABC系统介导G-AisoK跨膜运输的过程及胞内肽酶释放XisoK的机制
在验证该策略后,研究团队构建了通用 ncAA 递送与编码平台,通过 G-XisoK 结构实现 11 种以往难以获得或掺入效率极低的 XisoK 型 ncAA 的高效递送与表达。这些 ncAA 包括可进行点击化学标记的丙炔基氨基酸PrgisoK、用于蛋白瞬时相互作用捕获的光亮氨酸 pLisoK、用于研究翻译后修饰的丝氨酸-异赖氨酸 SisoK 以及可作为化学交联剂的氯代丙氨酸ClAisoK。该成果极大拓展了遗传密码扩展体系的化学多样性,为研究复杂蛋白功能提供了更强的工具支撑。
为进一步提高体系在复杂培养条件下的稳定性,研究团队通过定向进化优化了 OppA 的底物偏好。天然 OppA 在廉价培养基中容易被其他短肽竞争结合,导致 ncAA 摄取效率下降。研究人员首先利用易错 PCR 获得初步变体,再对关键热点位点进行定点饱和突变筛选,最终得到 OppA-iso。该变体在高竞争环境下仍能高效转运 G-SisoK。随后,他们又基于结构模型对围绕 Z 位点的四个残基(V60、S63、L530、N532)实施定点饱和突变,获得 OppA-Z1 和 OppA-Z2,使其能够识别带有更大或带负电的 Z 残基。整合 OppA-iso 基因后建立的工程菌株 IsoK12 在廉价培养基中表现优异,只需约 1/10 浓度的三肽即可获得与优化体系相当的蛋白产量,并能对多种 XisoK 衍生物实现稳定编码,显著降低了实验与工业成本。
在此基础上,研究团队进一步验证了该体系的扩展潜力。通过 Z-AisoK 三肽,他们能够同时运送两种不同类型的 ncAA。例如,在 AcK-pLisoK 设计中,单一三肽同时携带乙酰赖氨酸和光亮氨酸,进入细胞后被肽酶切割后分别释放两种 ncAA。得益于相互正交的氨酰 tRNA 合成酶/tRNA 对,这两种氨基酸能够被精准掺入蛋白的两个不同终止密码子位点。研究人员成功利用一个单一的三肽分子,首次实现了对单个蛋白两个不同位点的双 ncAA特异性掺入,从而在蛋白质翻译后修饰模拟与交互作用研究中提供了全新的实验平台。
图 | 基于Z-AisoK三肽的通用ncAA递送体系
该研究以细菌天然 Opp 系统为基础,通过结构识别机制解析与定向进化相结合的方式,实现了从被动扩散到主动转运的转变。与传统化学修饰或载体包裹策略相比,该体系具备更高的细胞摄取效率和可编程性,可通过结构定向进化实现对不同化学结构的兼容,从根本上拓宽了 GCE 的应用边界。
这一平台在多领域展现出潜在应用价值。其高效、低成本的递送能力可支持修饰蛋白质的大规模生产,也为开发具有新型催化、识别或信号功能的人工蛋白提供可能。未来,若将该策略与基因组重编码及体内 ncAA 生物合成技术结合,或能构建具备自主合成与利用非天然化学构件能力的合成生命体系。苏黎世联邦理工学院的这项工作展示了通过工程化改造天然系统实现高效分子递送的可行路径,并为合成生物学向更复杂、精确的化学空间迈进提供了坚实范例。
参考链接:
1.Iype, T., Fottner, M., Böhm, P. et al. Hijacking a bacterial ABC transporter for genetic code expansion. Nature (2025). https://doi.org/10.1038/s41586-025-09576-w
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































安各洛(深圳)生物科技有限公司 版权所有