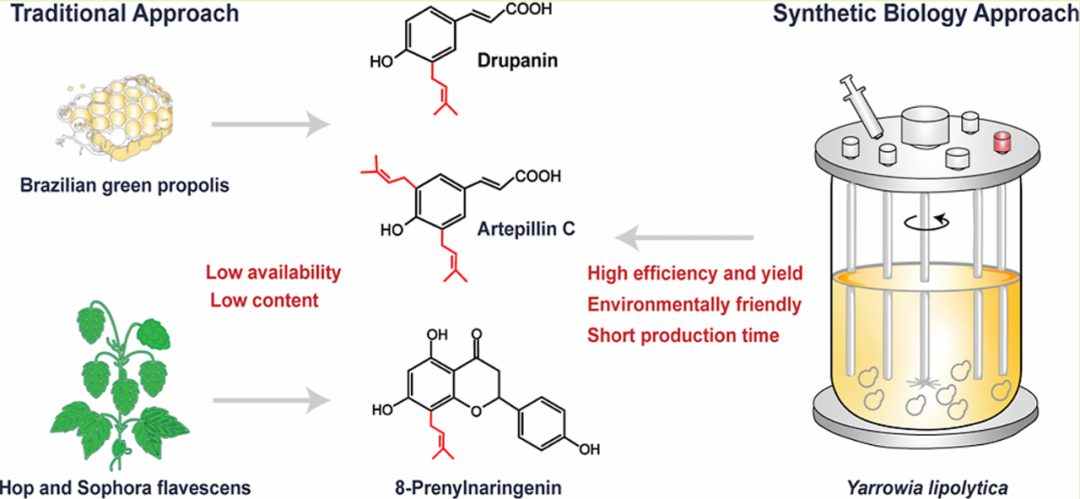
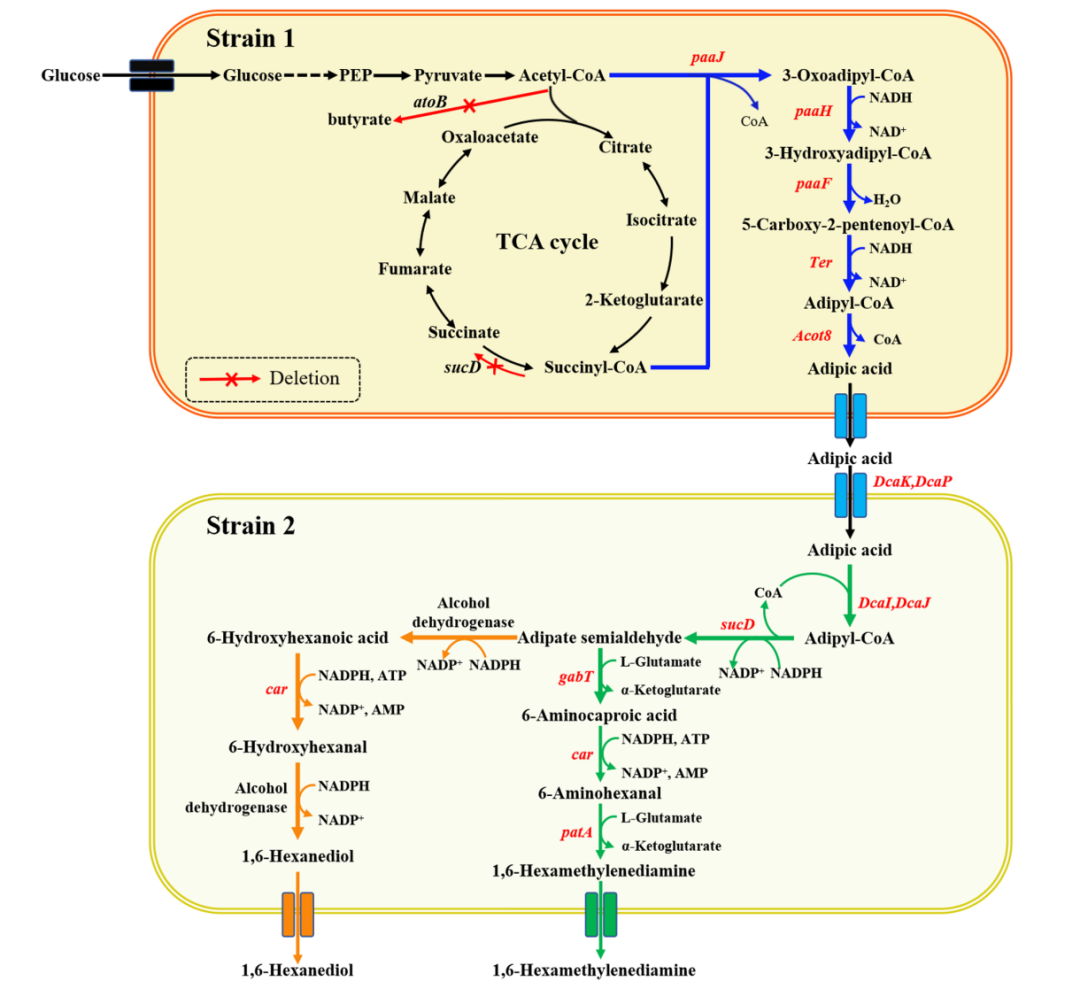
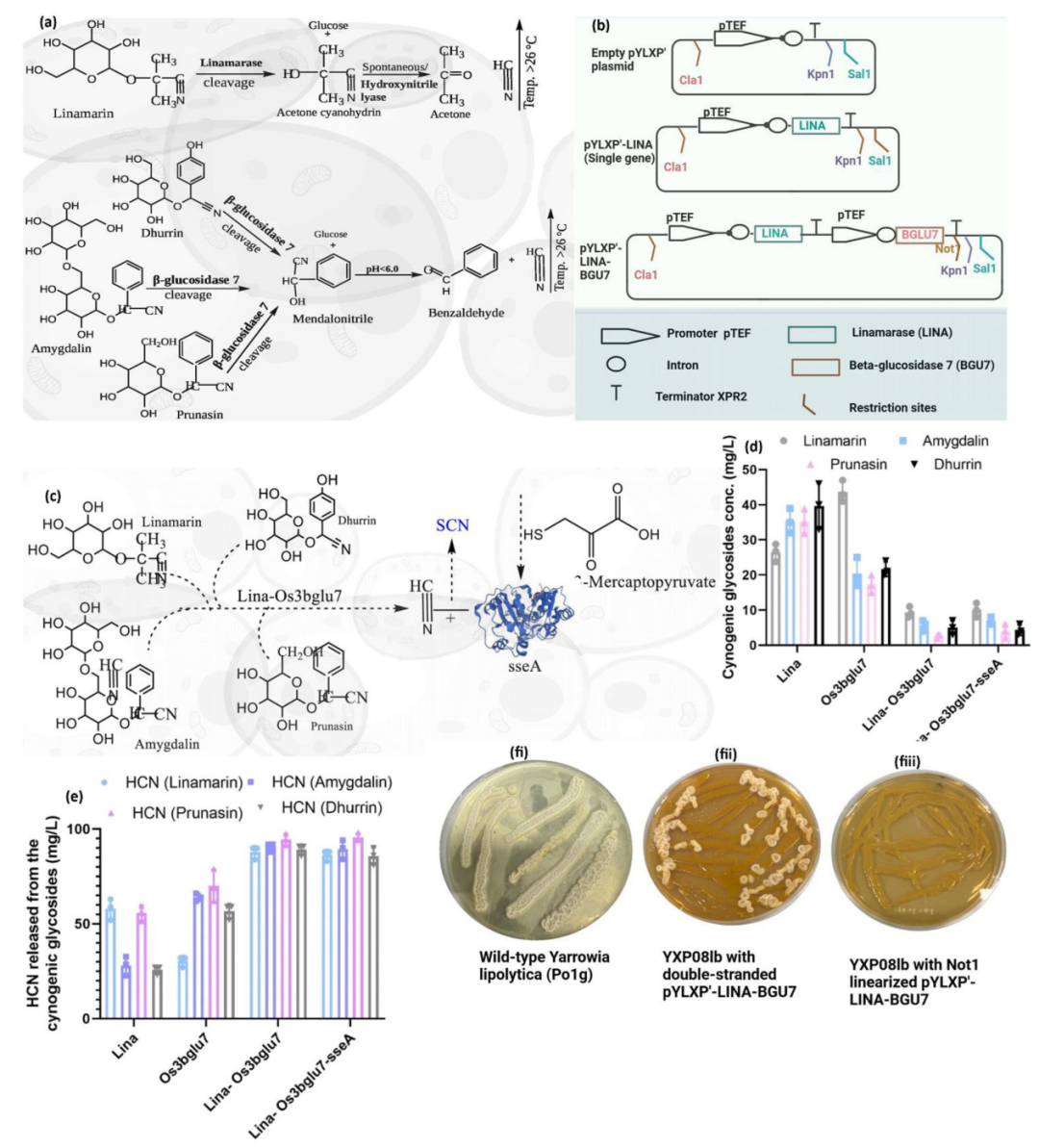
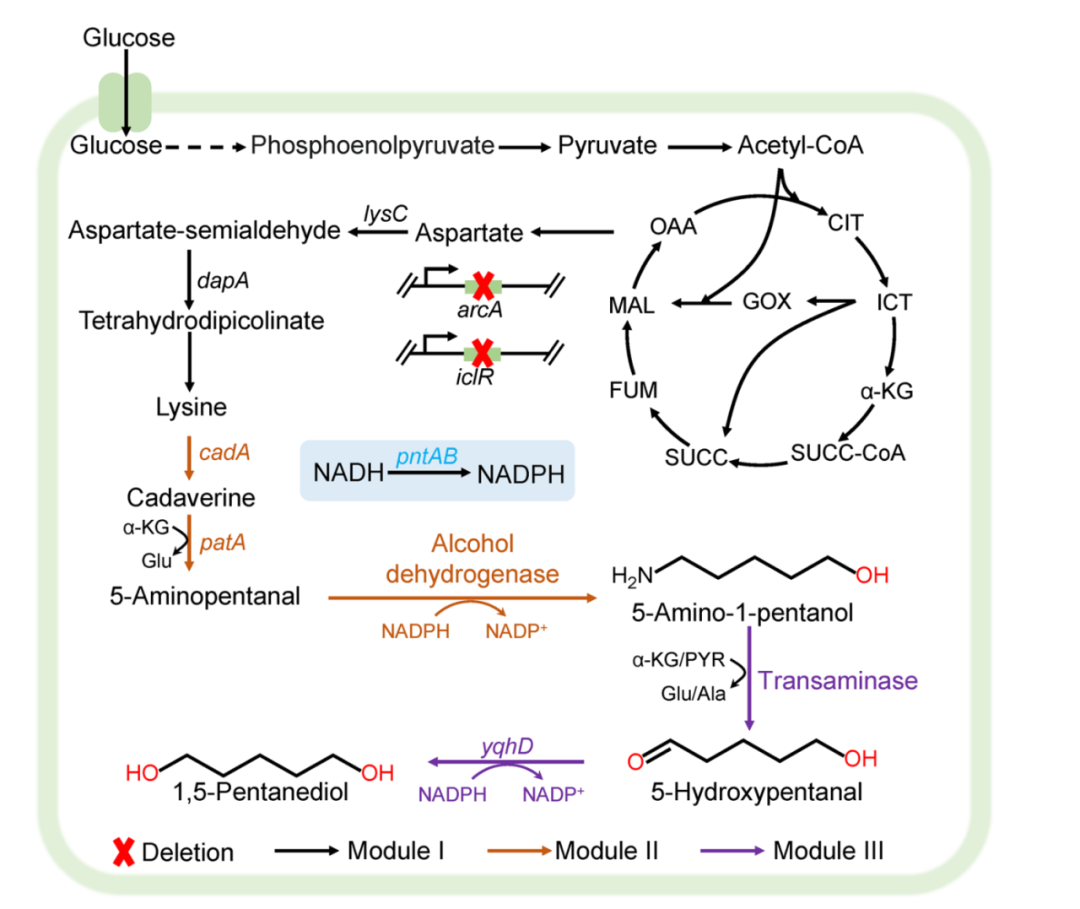
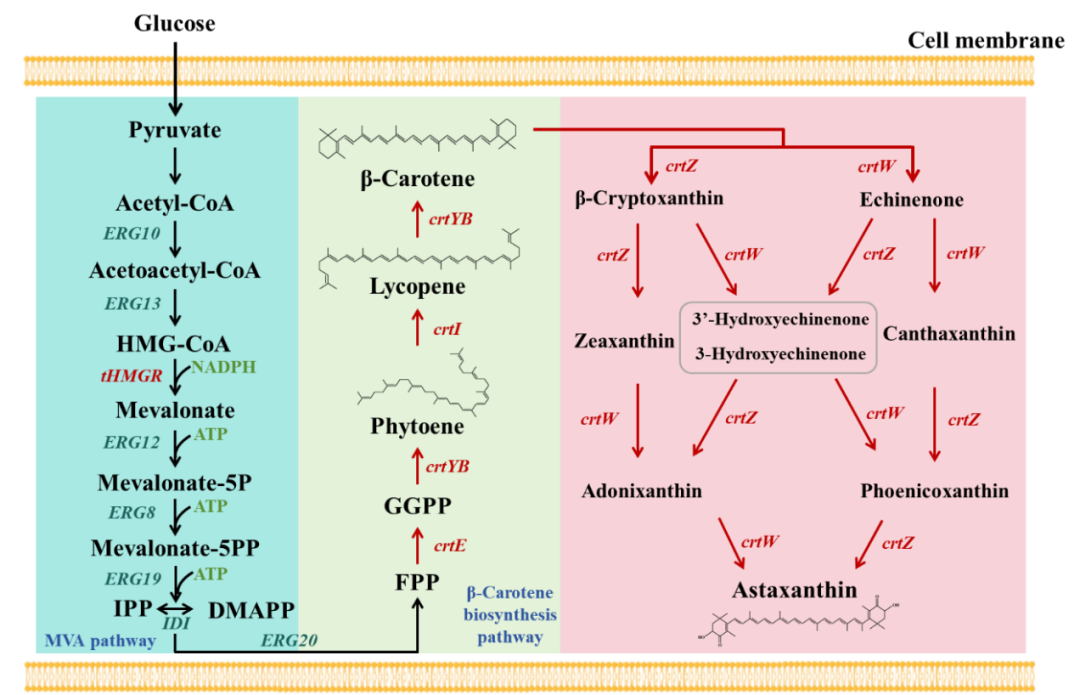
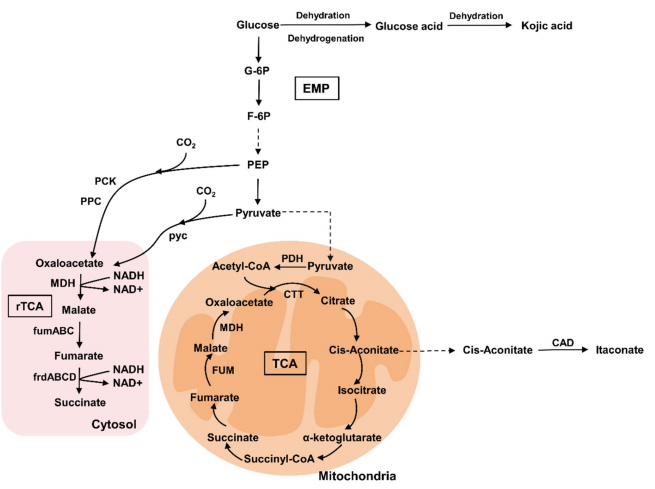
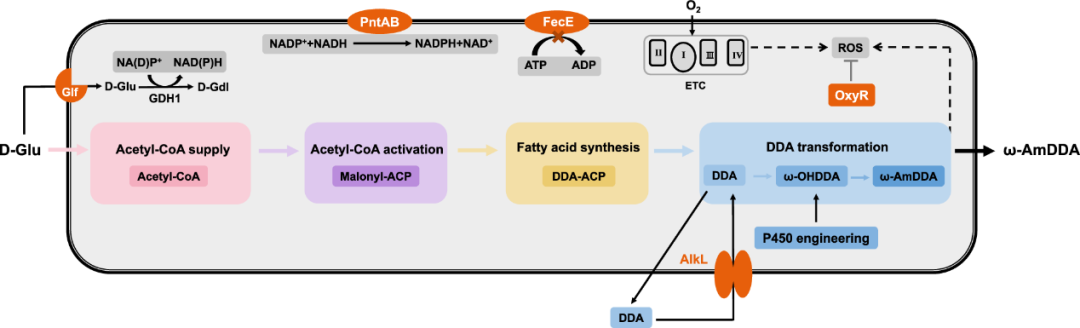
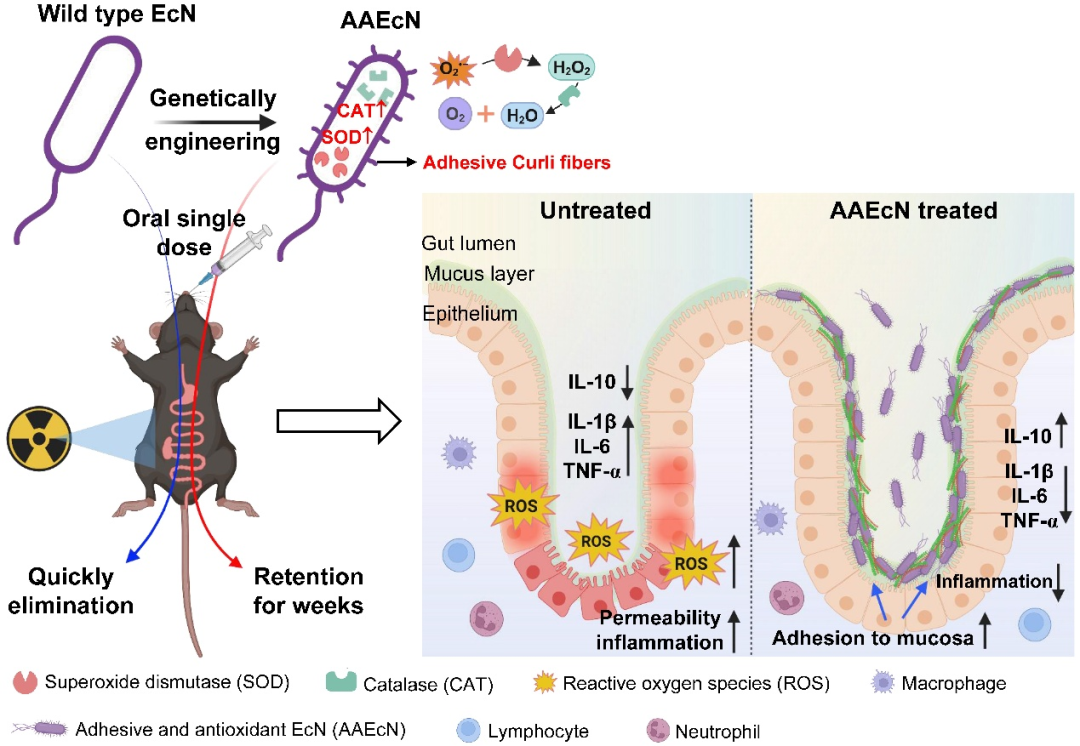
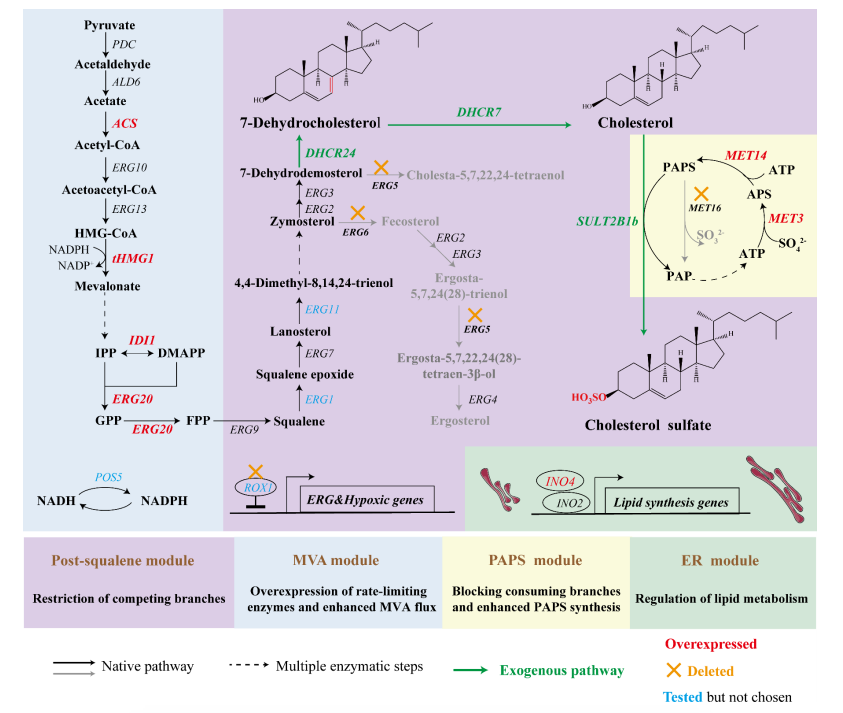
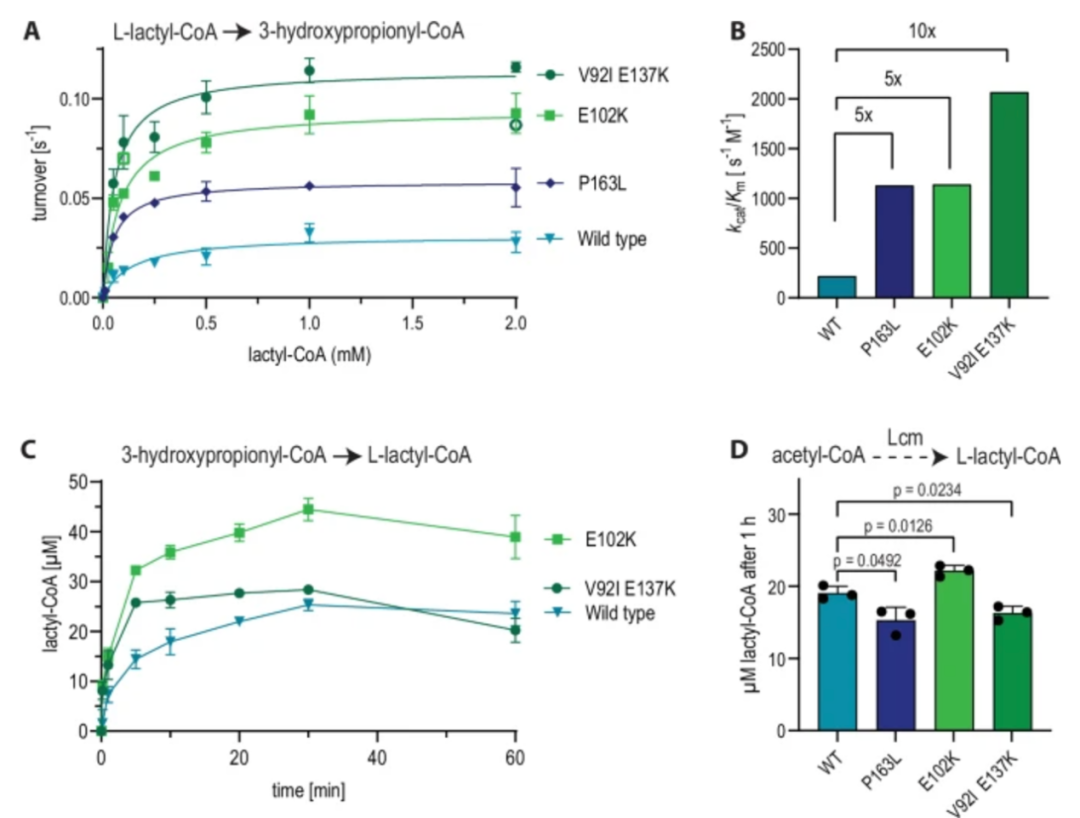
耐药性病原菌,尤其是大肠杆菌和志贺氏菌属细菌,正对全球公共健康产生着严重威胁,其引发的腹泻和尿道感染在发展中地区尤为严重。此外,世卫组织每年也更新发布最新细菌优先病原体预警清单,并强调迫切需探索新型治疗手段。
在该背景下,近日澳大利亚莫纳什大学 Rhys Grinter 教授团队在 Nature Communications 期刊发表了一篇题为“Inhibiting heme piracy by pathogenic Escherichia coli using de novo-designed binders to ChuA”的研究。该团队首次利用人工智能从头设计并成功合成了一种人工蛋白,能够靶向阻断病原性大肠杆菌的外膜转运蛋白 ChuA 与血红蛋白的结合,在无需使用抗生素的情况下,以低纳摩尔浓度实现强效抑菌,为应对细菌耐药性问题开辟了全新的技术路径。
研究中使用的 AI 蛋白质设计平台以诺贝尔奖获得者、生物化学教授兼华盛顿大学蛋白质设计研究所所长 David Baker 的工作为蓝本。此外,该平台还利用免费提供的蛋白质设计工具以及一些自主研发的解决方案来生成候选药物。
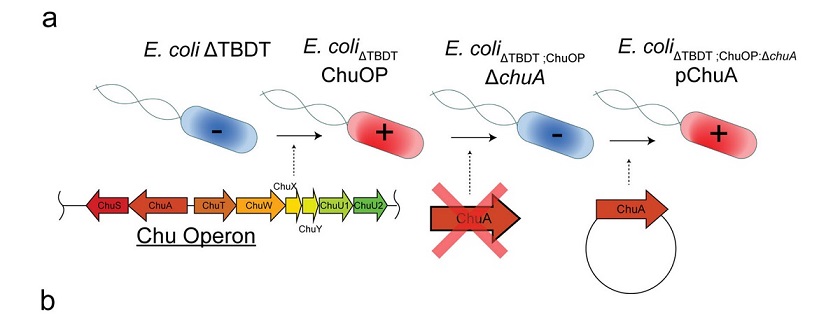
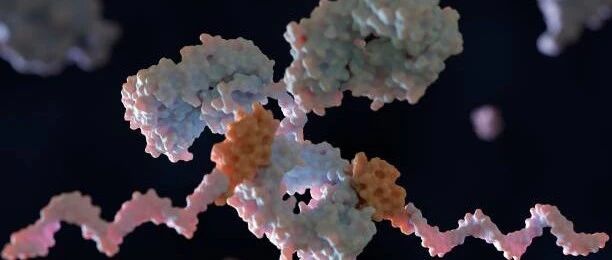
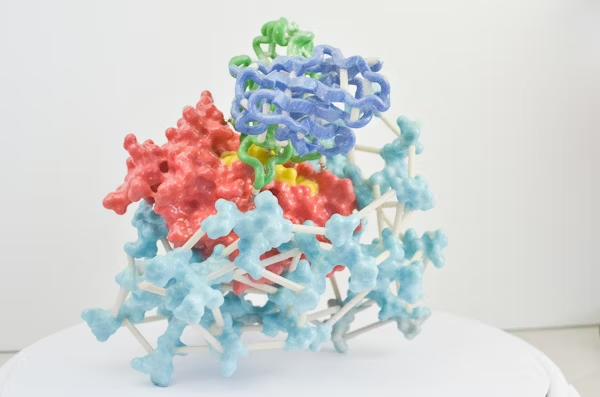
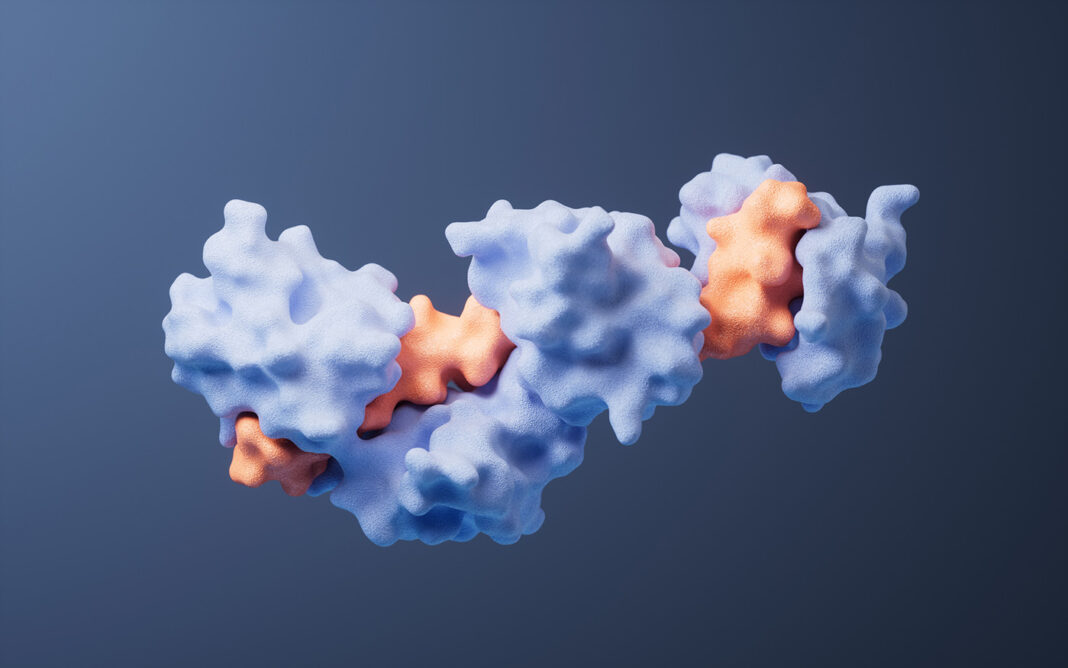
图 | AI 辅助设计蛋白通过竞争性结合阻断 ChuA 的血红素通道,实现营养剥夺式抑菌
该策略的核心是靶向病原菌表面的 ChuA 蛋白。ChuA 是一种位于革兰氏阴性菌外膜的转运蛋白,主要负责从宿主血红蛋白中摄取血红素辅因子,为细菌提供必需的铁元素。研究团队通过设计人工蛋白,精准阻断 ChuA 与血红蛋白的结合,切断细菌获取铁资源的通路,从而实现“营养剥夺式”抑菌效果。
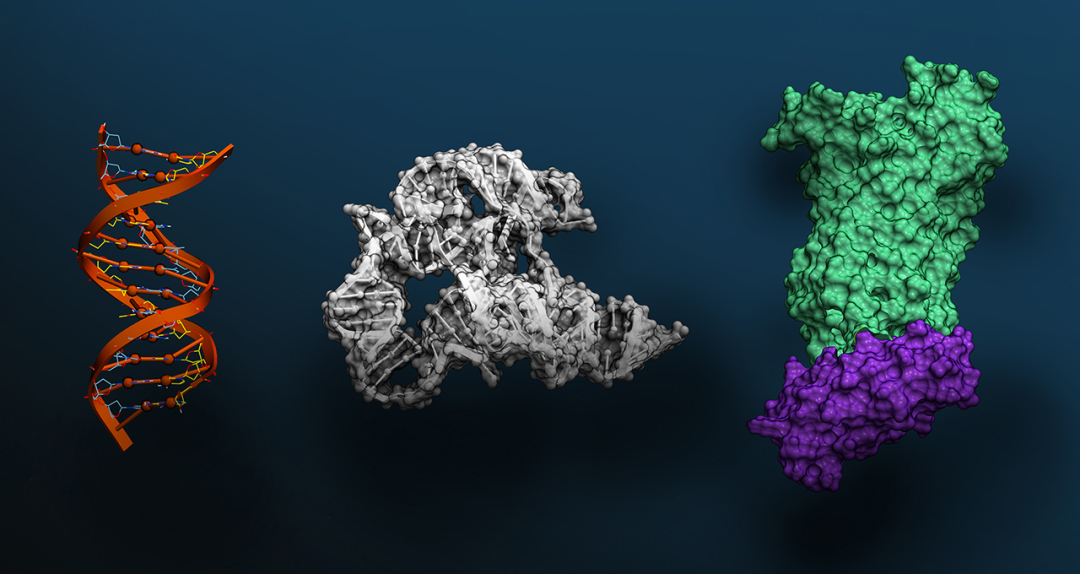
为此,研究人员首先借助冷冻电镜技术解析了 ChuA 的高分辨率结构,锁定其胞外环区作为血红素结合的关键位点,从结构基础上指导人工蛋白的靶向设计。
随后,研究团队利用AI结构生成工具——包括RFdiffusion和ProteinMPNN——设计出一系列可与 ChuA 胞外环特异结合的小型蛋白。该过程完全不依赖自然界存在的蛋白模板,而是采用“从头构建”的方式(de novo design),总共生成约 2 万个候选序列。
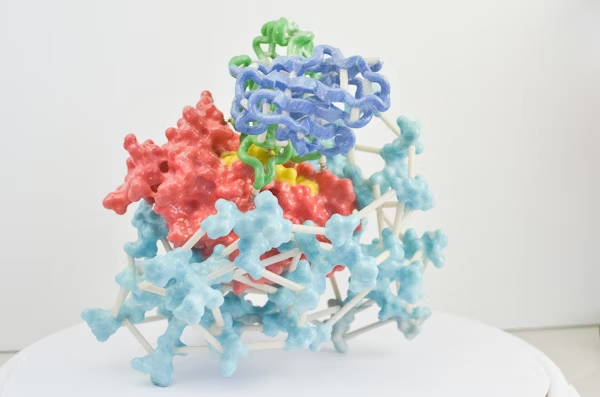
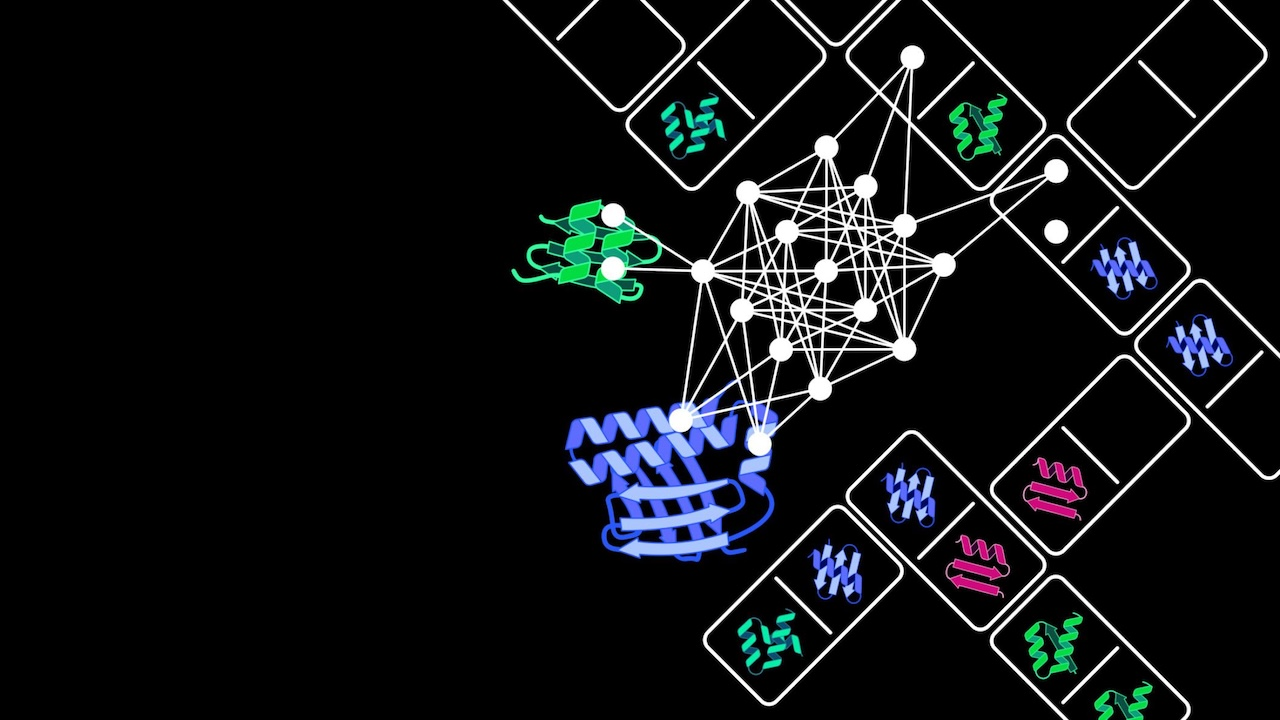
通过计算筛选与亲和力预测,团队挑选出了 96 个结构最优的候选蛋白进入体外实验验证环节。实验中,研究人员构建了以血红蛋白或肌红蛋白为唯一铁源的大肠杆菌培养系统,检测这些候选蛋白在不同浓度下的抑菌效果。结果表明,多个人工蛋白可在低至 42.5 纳摩尔浓度时实现对病原菌显著的生长抑制作用。其中命名为“G7”的蛋白表现最为出色,结合能力强,且抑菌效率高。
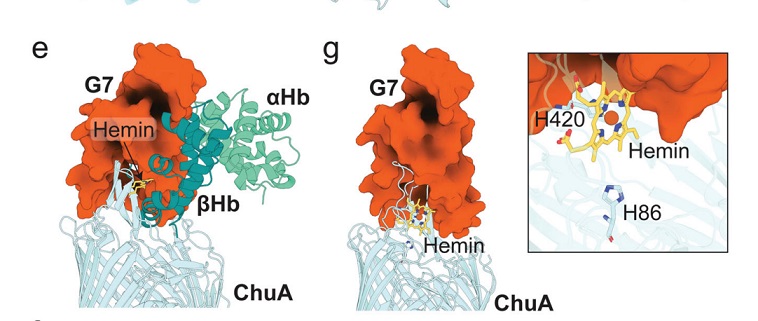
图 | 利用 AI 结构生成工具生成并筛选出抗菌效果最佳的人工蛋白 G7
最终,研究人员进一步利用 X 射线晶体学与 Cryo-EM 对蛋白–ChuA 复合体进行结构解析,发现人工蛋白与 ChuA 的结合模式也与 AI 预测高度吻合,验证了从设计到功能实现的全流程闭环。
与传统抗生素通过细胞壁或核糖体通路发挥杀菌作用不同,该技术重的人工蛋白是通过阻断铁供给来限制病原菌的生长,在理论上对耐药性的选择压力更小、演化风险更低。同时,ChuA 蛋白为病原菌特有,健康肠道菌株中不存在同源结构,使得该类人工蛋白在临床应用中更具靶向优势与安全边界。
值得一提的是,该团队的设计思路深受此前 David Baker 团队的研究启发。2025 年 1 月,华盛顿大学医学院与丹麦技术大学合作团队在 Nature 发表题为“De novo designed proteins neutralize lethal snake venom toxins”的成果。他们首次利用深度学习方法(包括 RFdiffusion 模型和 ProteinMPNN 算法)从头设计能特异中和剧毒蛇毒素的蛋白,有效结合三指毒素(3FTx)家族中的 α 神经毒素与细胞毒素。在有限实验筛选下,所设计蛋白不仅热稳定性极佳、结合亲和力高,还在小鼠体内实现了 80-100% 的中毒保护率,且设计结构与 AI 预测高度吻合。Grinter 团队正是在此基础上将设计思路延伸至病原菌膜蛋白,靶向阻断细菌铁摄取路径,探索了 AI 蛋白设计在抗菌领域的进一步可能。
研究人员指出,该思路未来还可扩展至其他跨膜摄取蛋白,如铜、锌等营养元素转运体,或应用于结核分枝杆菌、铜绿假单胞菌等耐药性强的病原体的防控。
总之,本研究提出了一种全新的的“营养封锁型抗菌”思路,首次展示了 AI 从头设计蛋白阻断病原性大肠杆菌生理功能的可行性。相较传统药物研发,该技术流程更加快捷、成本低、可扩展性强,且具备极高的结构与功能精准性,是 AI 技术与合成生物学融合的一个重要里程碑。未来,随着算法能力与蛋白合成技术的进一步发展,这类智能蛋白有望成为应对抗药性挑战的关键工具,广泛应用于感染治疗、微生态调控、疫苗佐剂设计等领域。
参考文献:
1. Fox, D.R., Asadollahi, K., Samuels, I. et al. Inhibiting heme piracy by pathogenic Escherichia coli using de novo-designed proteins. Nat Commun 16, 6066 (2025). https://doi.org/10.1038/s41467-025-60612-9
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。























































































































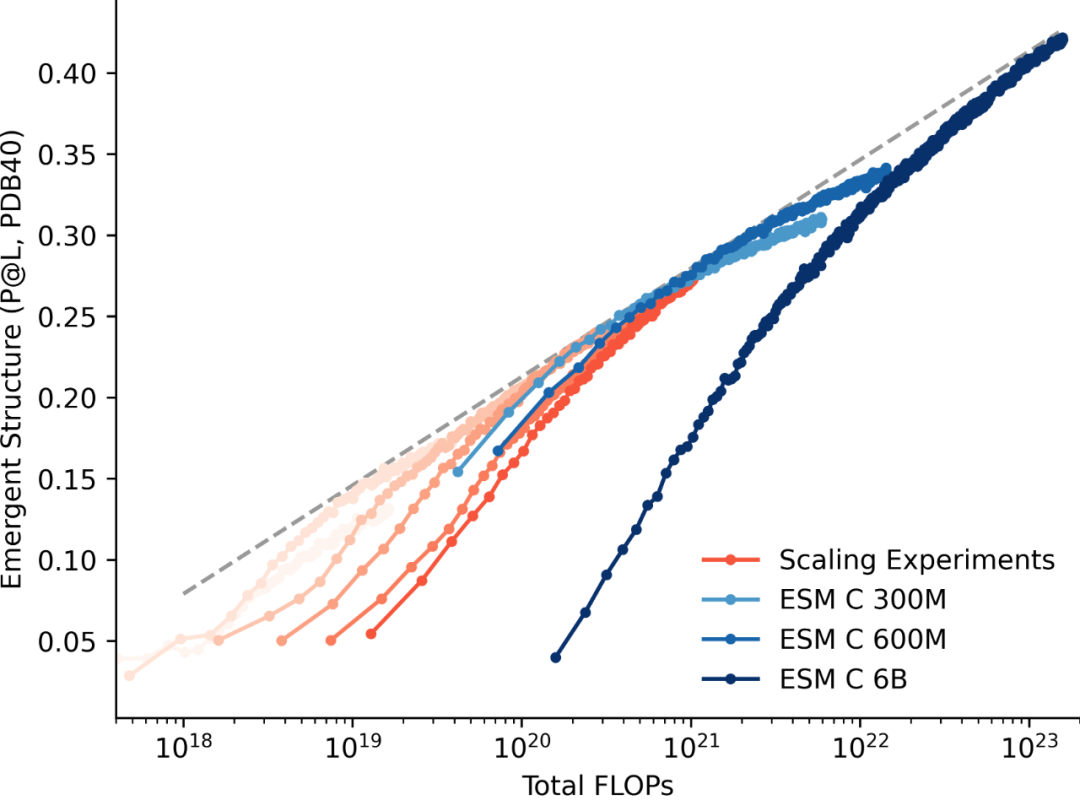

































































安各洛(深圳)生物科技有限公司 版权所有