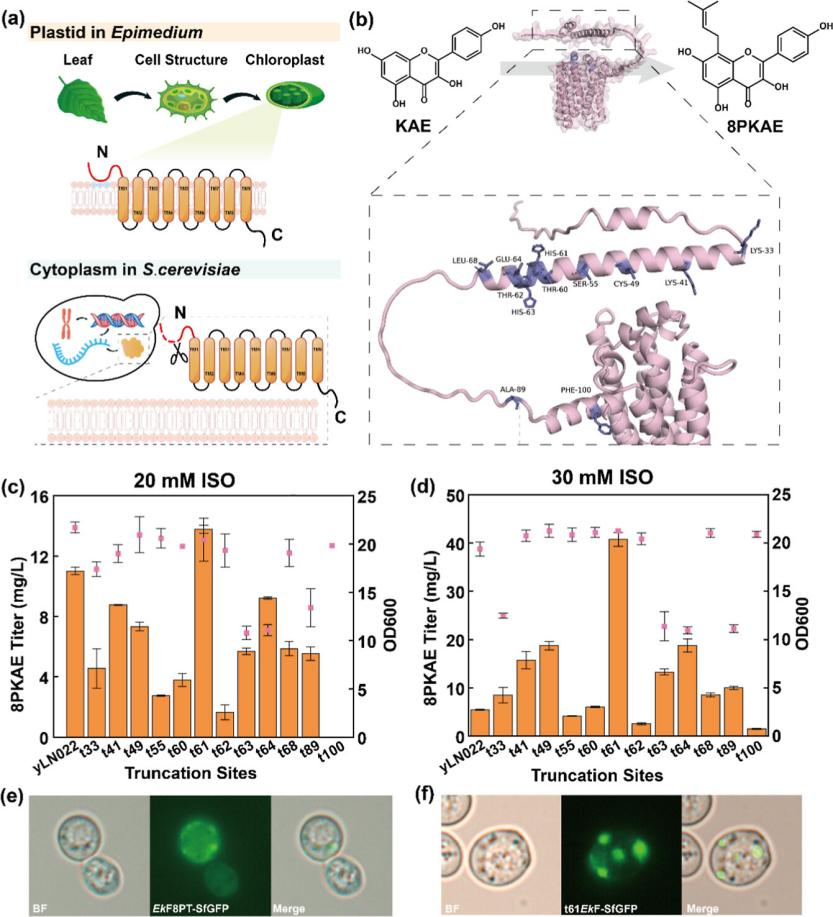
在哺乳动物细胞中,染色体上的 DNA 携带着种类繁多的表观遗传修饰,这些记忆决定了哪些基因会被激活、哪些会沉默。然而,自然染色体上的修饰难以完全抹除,导致科学家很难研究这些修饰是如何最初被建立起来的。
若想理解表观调控的基本原理,理想的模型是:一段“白纸状态”的大段人类 DNA,能被精确注入动物胚胎,在其自然发育过程中观察表观遗传修饰的逐步建立。
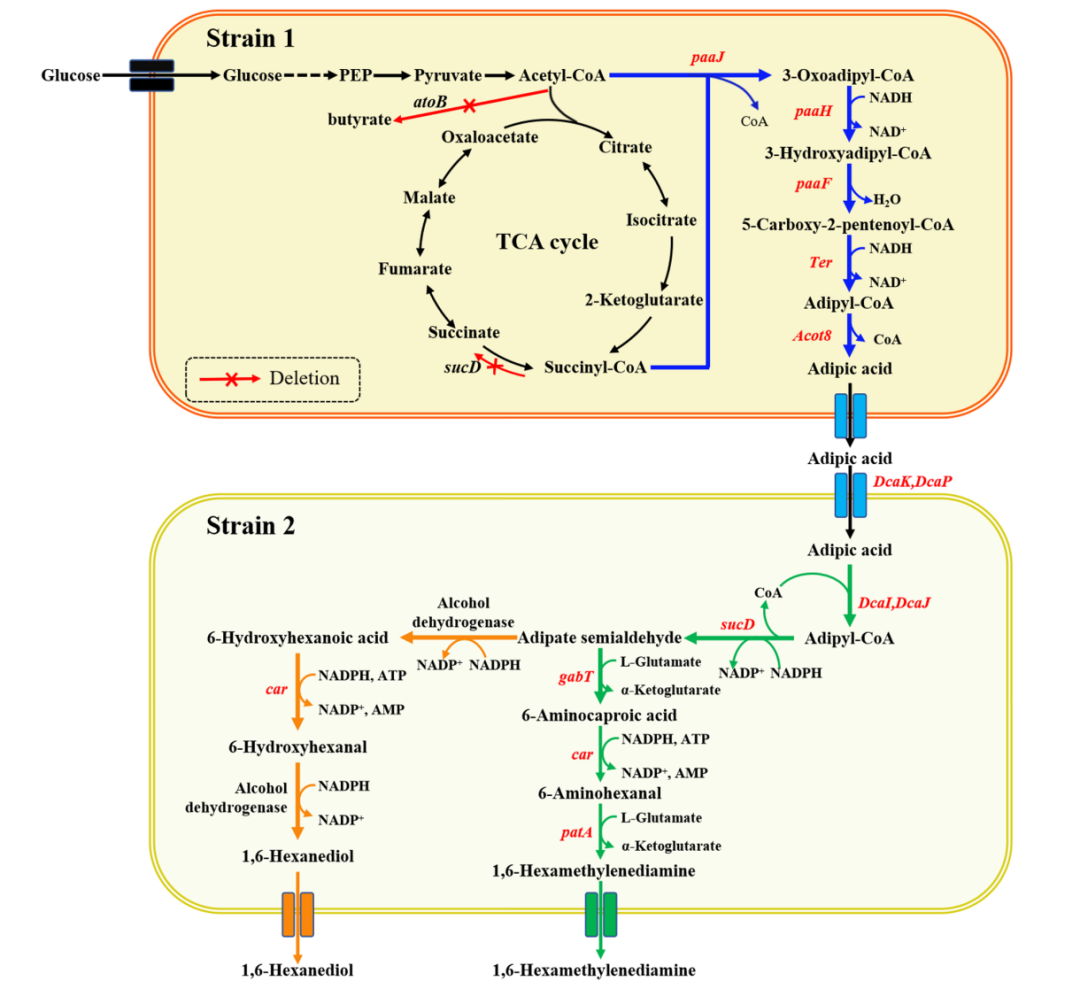
面对这一挑战,近日,天津大学元英进团队与清华大学、浙江大学等研究团队提出并实现了一项突破性方案:他们开发了 SynNICE 方法,组装并递送了 1.14Mb 的人类 AZFa 片段(hAZFa),并成功注入小鼠卵母细胞,建立了“从零开始”的跨物种表观遗传研究模型,相关成果以“De novo assembly and delivery of synthetic megabase-scale human DNA into mouse early embryos”在线发表于 Nature Methods 期刊。
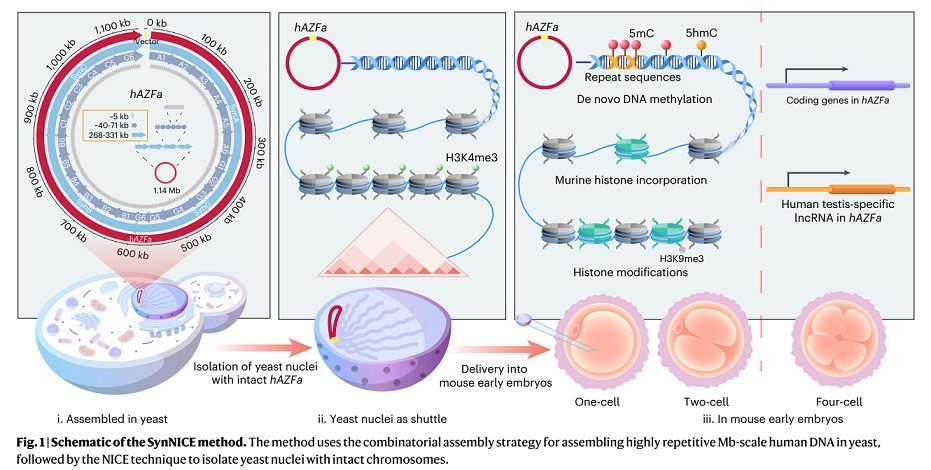
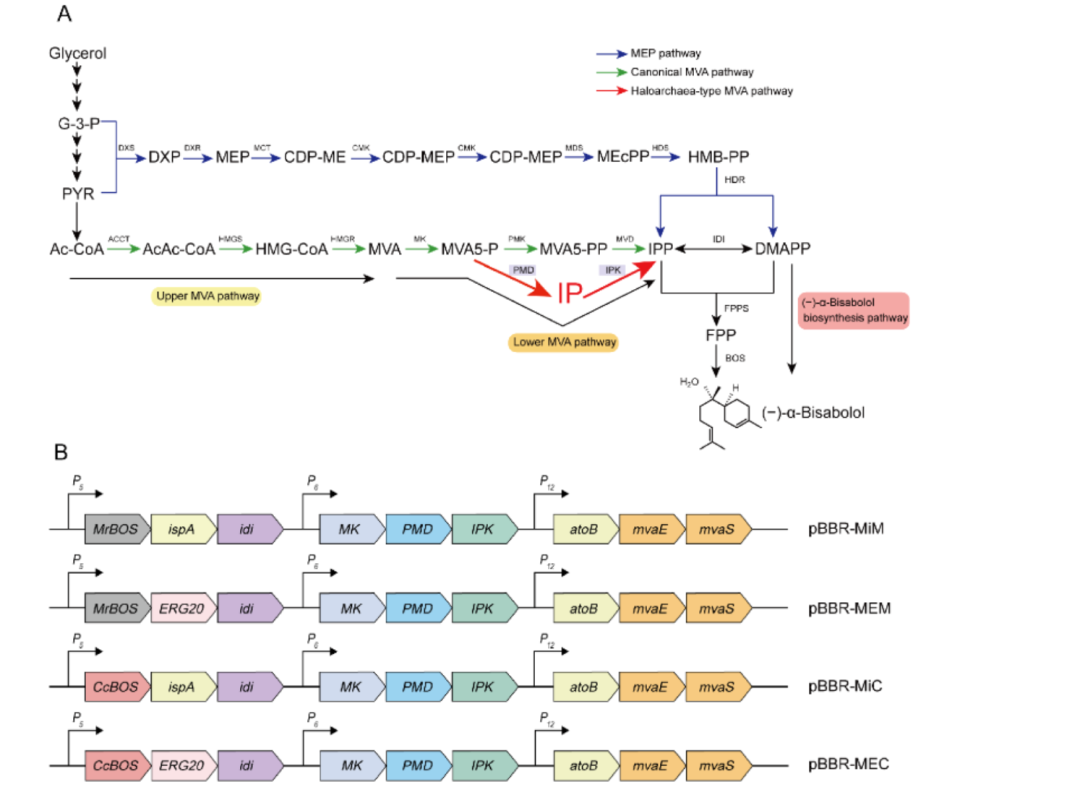
图|SynNICE 技术的三步策略
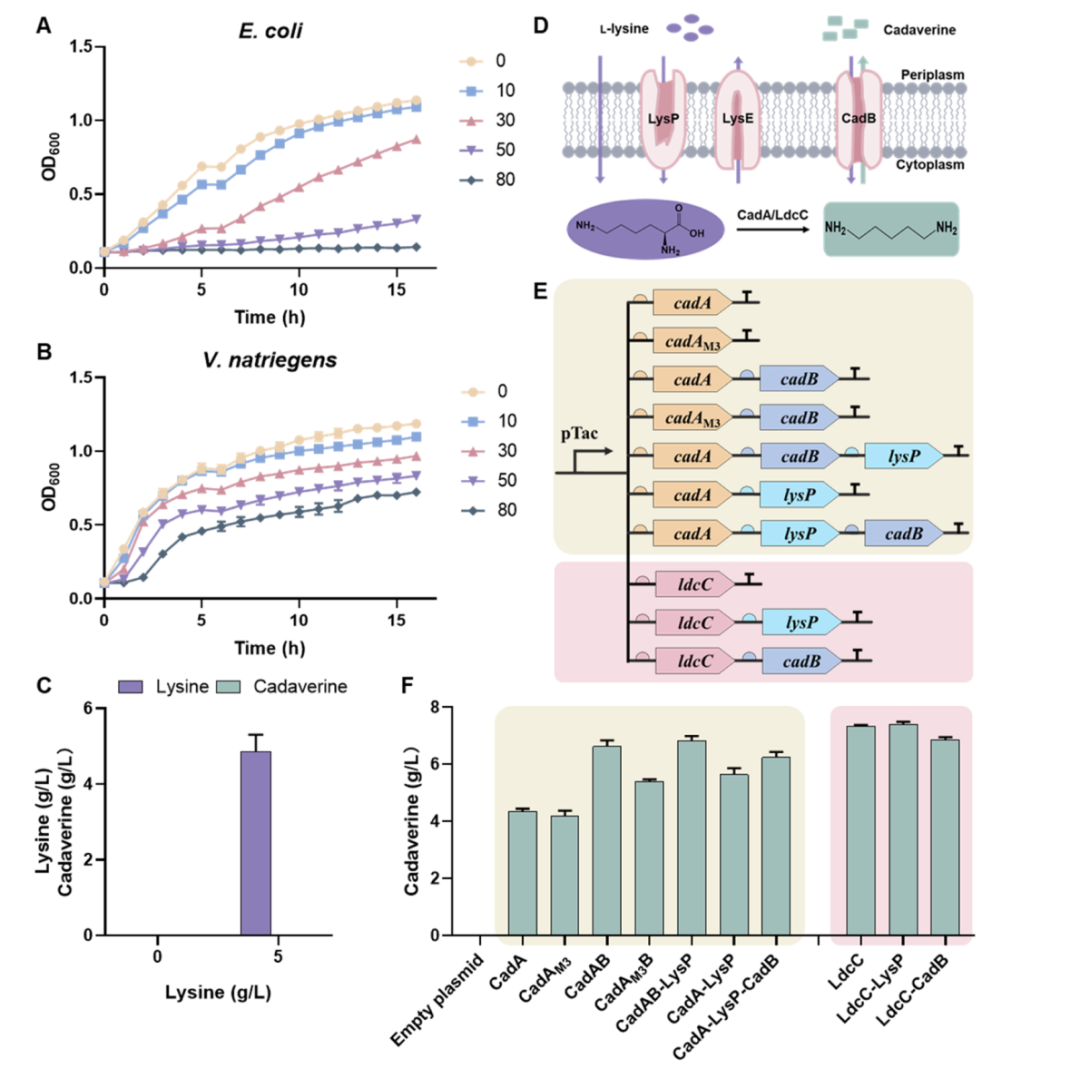
SynNICE 技术的核心在于通过化学合成、酵母组装和酵母细胞核递送的结合来实现高效的 DNA 合成和递送。
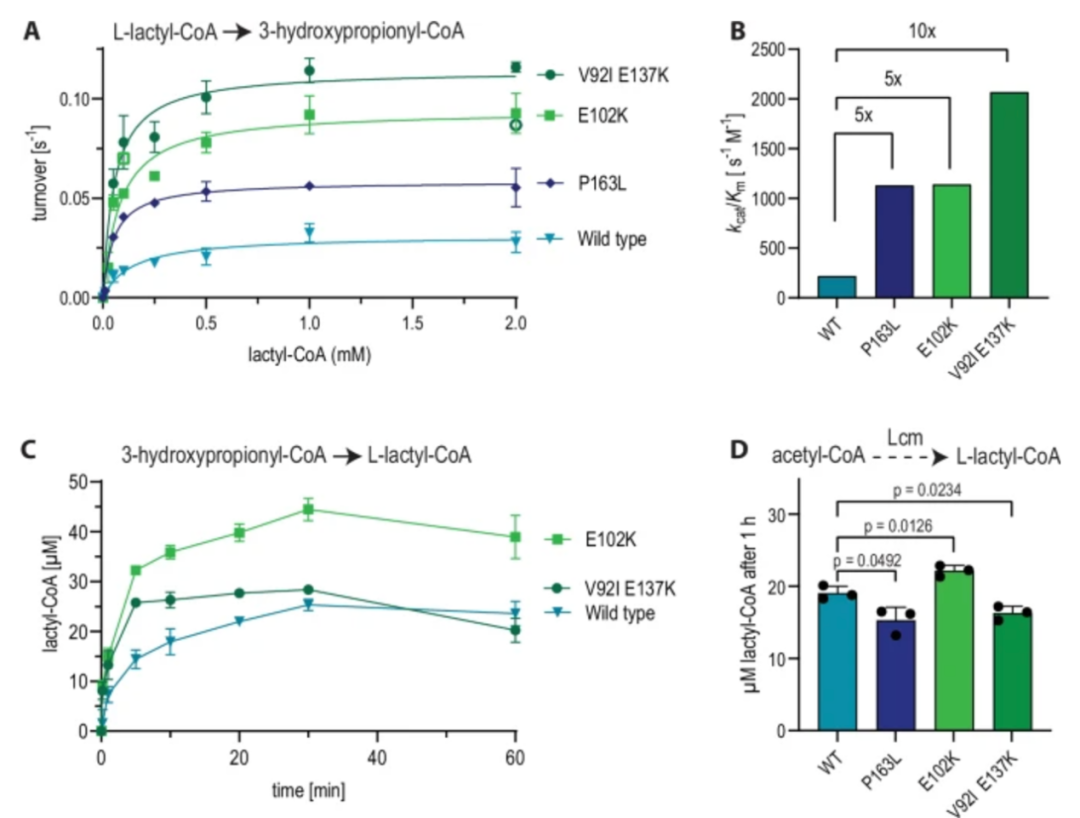
首先,研究团队通过化学合成技术设计了人类 AZFa 片段的序列,这个区域来自于人类 Y 染色体,与男性不育密切相关,并且包含大量的重复序列和调控元件。为实现高保真合成,团队将其划分为 233 个 5 kb 左右的短片段,分三步在酵母细胞中通过同源重组逐步组装:小片段拼接为 23 个中段(40–70 kb);再整合为四大段(SynA、SynG、SynB、SynC);最后通过 CRISPR 引导的酵母配对,实现完整组装。
在组装过程中,团队采用了 CRISPR 技术来引导酵母细胞进行精确配对和组合,最终成功实现了完整 DNA 序列的组装和稳定。研究验证表明,所合成的 hAZFa 在酵母中表现出极好的稳定性,能够持续 50 代传代而不发生断裂,并且保持了染色体的三维结构。通过 Hi-C 实验,团队证实了这些合成的 DNA 序列在酵母细胞中能形成独立的高阶染色质结构,为进一步的研究奠定了基础。
为解决大段 DNA 在递送过程中的降解与结构破坏问题,团队开发了细胞核分离和染色体提取技术(NICE),即通过 DNase 抑制剂与多胺保护剂的联合处理,从酵母中提取保留核膜完整性的细胞核(核体),其中包裹的合成 hAZFa 片段保持染色质紧凑性与表观活性。
最终,染色质可及性检测(ATAC-seq)及染色质构象分析(Hi-C)证实,分离后的细胞核中 hAZFa 仍保持较高的结构紧凑性与表观活性状态。随后,研究人员将这些带有人源 DNA 的酵母细胞核,通过显微注射的方式注入至小鼠的成熟卵母细胞中。显微成像显示,注射后核体可在细胞质中稳定存在,并被小鼠组蛋白(H3.3、H2B)自发替换包裹,显示出显著的染色质重建行为。
令人惊喜的是,这段原本没有任何表观修饰的人源 DNA,在小鼠卵母细胞中开始经历从零开始的 DNA 甲基化过程。
研究发现,注射 8 小时内,hAZFa 的 DNA 就开始出现 5-甲基胞嘧啶(5mC)与羟甲基化(5hmC)信号。全基因组亚硫酸盐测序(WGBS)显示,hAZFa 中的 CpG 位点约 46.35% 被甲基化,且主要富集在重复序列区域,这种甲基化分布与人类胚胎早期的重编程特征高度一致,进一步验证了这种甲基化过程是特定的,而非随机发生的。
不仅如此,研究团队发现这段人类基因片段在小鼠胚胎内的基因表达也被成功激活。RNA-seq 分析显示,hAZFa 中的关键基因(如 DDX3Y、UTY、长链非编码 RNA TTTY15)在四细胞阶段开始表达,并且这种表达与人类自然胚胎中的激活时序相吻合。这些基因的表达依赖于 DNA 甲基化的去除及酶促活化(如 TET),这表明 DNA 甲基化在调控这些基因的转录过程中发挥着核心作用。
总的来说,这项研究首次提出并实现了一个全新的哺乳动物表观遗传研究模型。通过 SynNICE 技术,研究人员成功合成并递送了完整的人类基因片段,且在小鼠胚胎中实现了从零开始的 DNA 甲基化与基因表达。一方面,该研究为深入解析基因表达调控机制提供了全新工具;另一方面,该研究为染色体异常相关疾病的治疗开辟了新思路、提供了新技术,未来有望在此基础上发展出针对染色体疾病的创新性治疗方案,并推动其向临床应用进一步转化。
参考文献:
1. Liu, Y., Zhou, J., Liu, D. et al. De novo assembly and delivery of synthetic megabase-scale human DNA into mouse early embryos. Nat Methods (2025). https://doi.org/10.1038/s41592-025-02746-8
免责声明:本文旨在传递合成生物学最新讯息,不代表平台立场,不构成任何投资意见和建议,以官方/公司公告为准。本文也不是治疗方案推荐,如需获得治疗方案指导,请前往正规医院就诊。
























































































































































































安各洛(深圳)生物科技有限公司 版权所有