自然界中,几乎所有生命都使用同一套“语言”——由 20 种氨基酸组成的遗传字母表。尽管科学家们后续发现了硒代半胱氨酸和吡咯赖氨酸这两种特殊氨基酸,但天然“字母”的数量依然有限,这从根本上约束了蛋白质结构功能的多样性。
为了突破这一天然限制,一种名为“遗传密码子扩展技术”(Genetic Code Expansion, GCE)的工具应运而生。通过引入非天然氨基酸(non-canonical amino acids, ncAAs),科学家得以创造出带有全新化学反应位点的蛋白质。这些蛋白质可以发光、可以作为共价偶联的抓手,甚至携带药物分子,执行自然界中不存在的化学反应。
然而,一个看似简单的问题,却成为这项技术的最大障碍——这些“外来”的氨基酸,很难进入细胞。 它们就像站在城门外的信使,既不能自由扩散,也难以被天然转运蛋白识别,这导致它们在细胞内部浓度极低,严重拖累蛋白质表达效率。
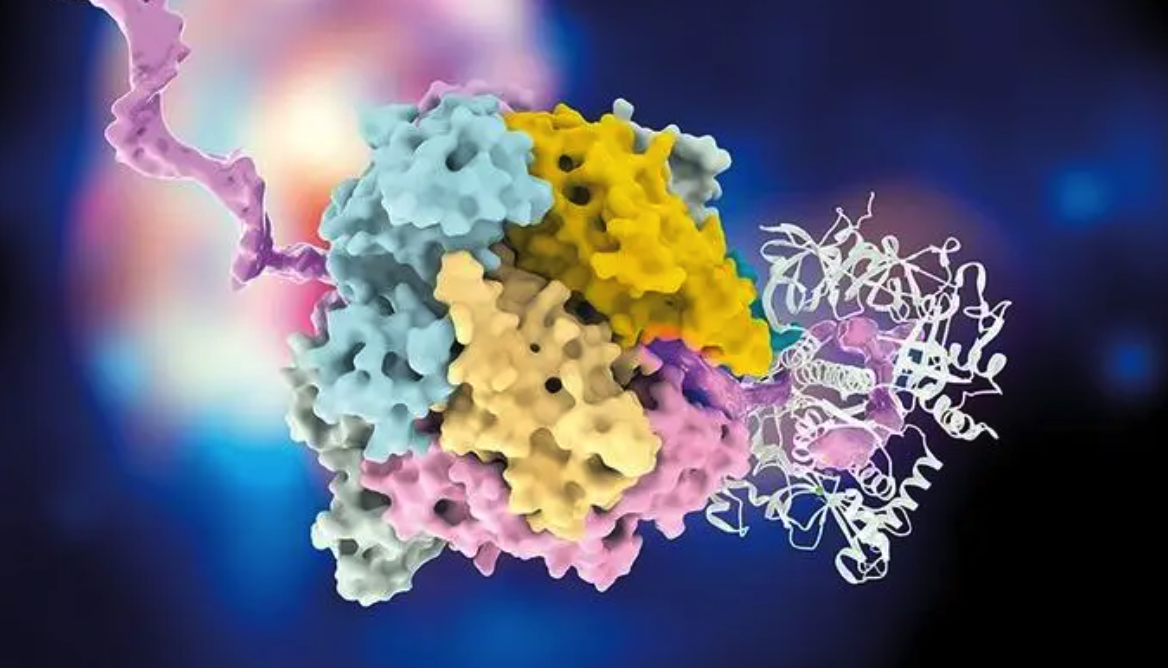
Part.01 特洛伊木马策略与 ABC转运蛋白的碰撞 过去,科学家提出一种“特洛伊木马”式的策略。第一步:让非天然氨基酸和一种细胞能识别的分子绑在一起。第二步:通过运输系统“搭便车”进入。第三步:在细胞内将非天然氨基酸“解锁”释放出来。这一思路虽巧妙,但不同细胞、不同分子的“通行规则”各不相同,因此难以实现通用化。 于是,研究者将目光投向了细胞中最强大的运输机器之一,ABC 转运蛋白(ATP-binding cassette transporter)。 ABC转运蛋白运输金属离子、氨基酸、寡肽等化合物 图片来源:10.1631/jzus.B2300641 ABC转运蛋白可以利用 ATP 的能量,将各种物质逆浓度梯度主动运进或运出细胞,是生物世界的“能量驱动货运系统”。 如果能让ABC转运蛋白识别并主动运送非天然氨基酸,问题不就迎刃而解了吗? Part.02 搭三肽的“便车”: 非天然氨基酸顺利入城 最近,一项发表在《自然》(Nature)杂志上的研究取得了关键突破(https://www.nature.com/articles/s41586-025-09576-w)。研究团队设计了一类特殊的三肽键合物 Z–XisoK,让细胞自己“开门”迎接非天然氨基酸。其中Z代表天然残基而X代表非天然残基,两者通过一种“异肽键”(isopeptide linkage)连接。 这个三肽分子的精妙之处在于:一旦进入细胞内部,三肽会被内源肽酶 PepN / PepA 切开,释放出目标 非天然氨基酸(XisoK)以及N 端的 Z 残基。此时 XisoK 在细胞内浓度显著升高,便可直接作为底物被 aaRS/tRNA 系统引入蛋白质中,实现高效率编码。换句话说——研究者成功“劫持”了 Opp ABC 转运蛋白,让它主动帮忙运送外来氨基酸。 推测的Opp系统的多肽摄取机制:周质中的G-AisoK与OppA结合后,被运送至膜上的OppB与OppC,随后在ATP供能下被主动转运至细胞质,并由pepA和pepN酶切为AisoK。而空载的OppA则从膜蛋白复合体释放,开启新一轮循环。 图片来源:10.1038/s41586-025-09576-w
效果如何?通过这套“搭便车”策略,研究团队成功引入了 11 种过去几乎无法利用的非天然氨基酸,包括可用于点击反应的位点、光交联氨基酸、化学连接手柄以及模拟翻译后修饰的特殊氨基酸。这些分子为蛋白质带来了前所未有的化学自由度。 Part.03 更进一步: 优化“专属通道” 研究者并未止步于此。他们通过定向进化技术,对转运蛋白的关键部分 OppA 进行了改造,使其能优先识别目标三肽,而不受培养基中的短肽干扰。将该基因整合到大肠杆菌基因组后,细胞获得了稳定、高效的“专属通道”,甚至能让一个三肽同时携带两种非天然氨基酸——为双位点功能化提供了新的可能。 当遗传密码扩展技术与转运蛋白工程化结合,细胞终于可以主动吸收、识别并利用原本“非经典”的氨基酸,构建自然界从未见过的蛋白质结构。科学家正在更接近“重写生命的化学字母表”的愿景。这一突破不仅将推动基础生物学研究,也为新型生物材料、药物研发(如更稳定、功能特异的多肽或蛋白质药物)等领域,开辟了前所未有的可能性。
原文参考: Hijacking a bacterial ABC transporter for genetic code expansion https://www.nature.com/articles/s41586-025-09576-w























































































安各洛(深圳)生物科技有限公司 版权所有