传统方法 最佳转染条件 质粒DNA和稳定细胞系mRNA表达的比较 生产真正的抗体 实时监控整个流程 优势与劣势总结

























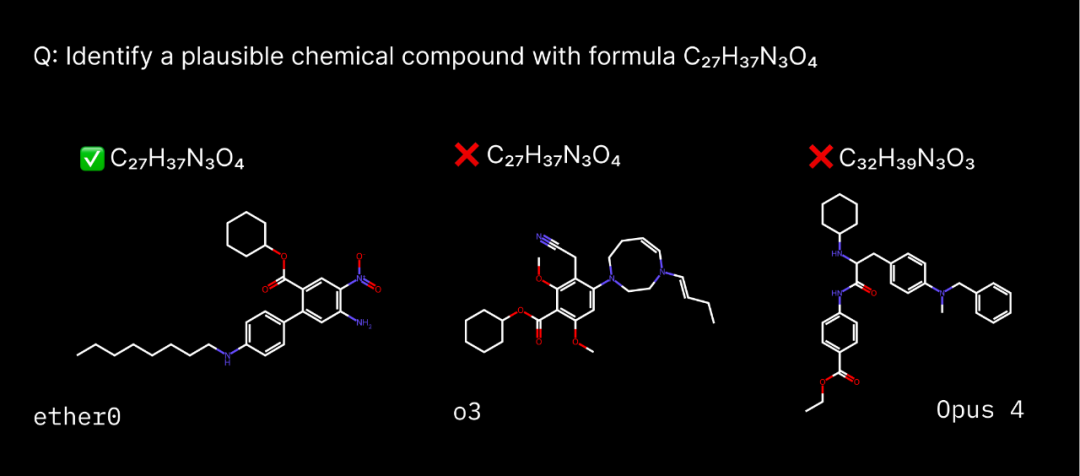



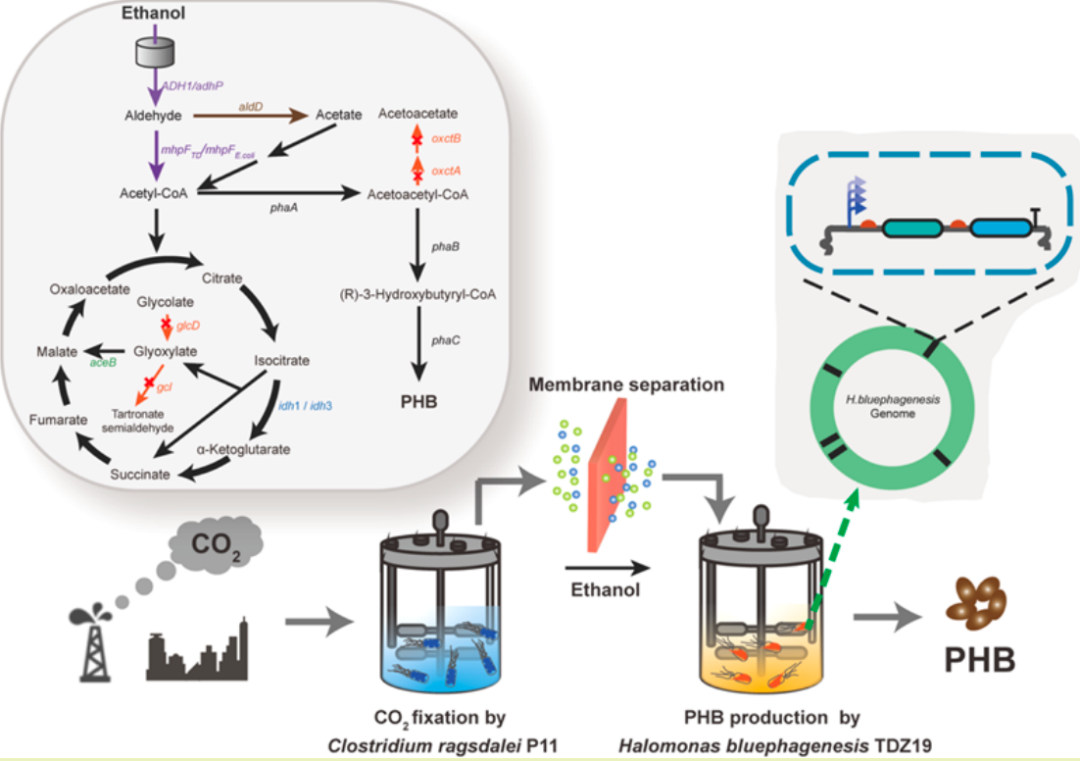
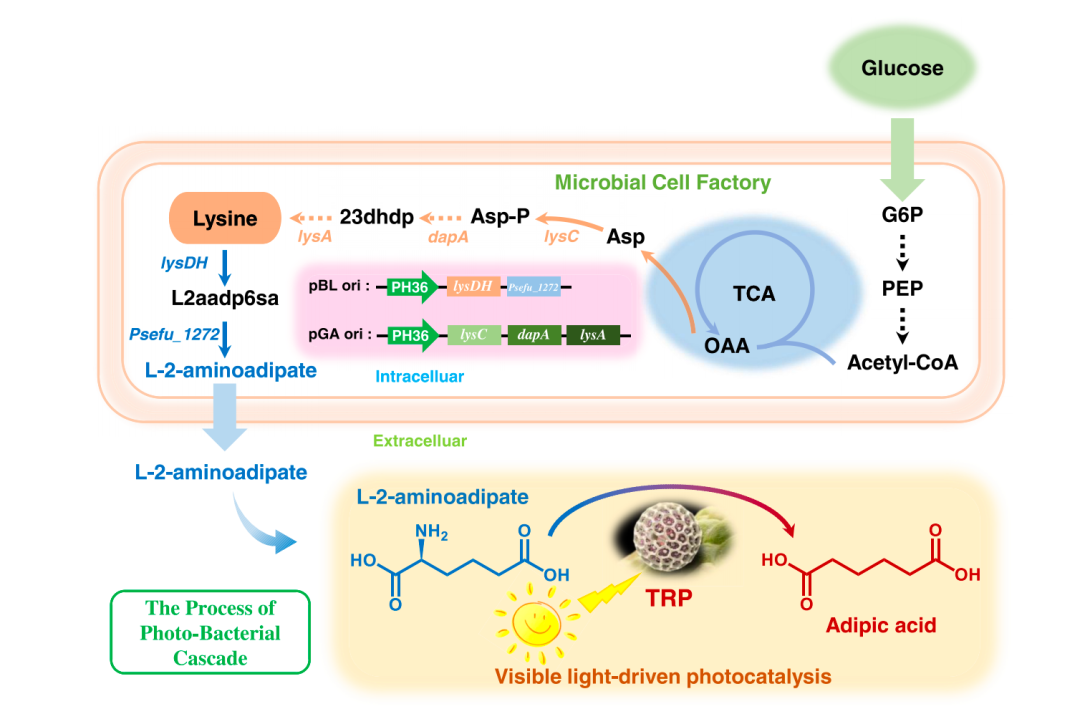





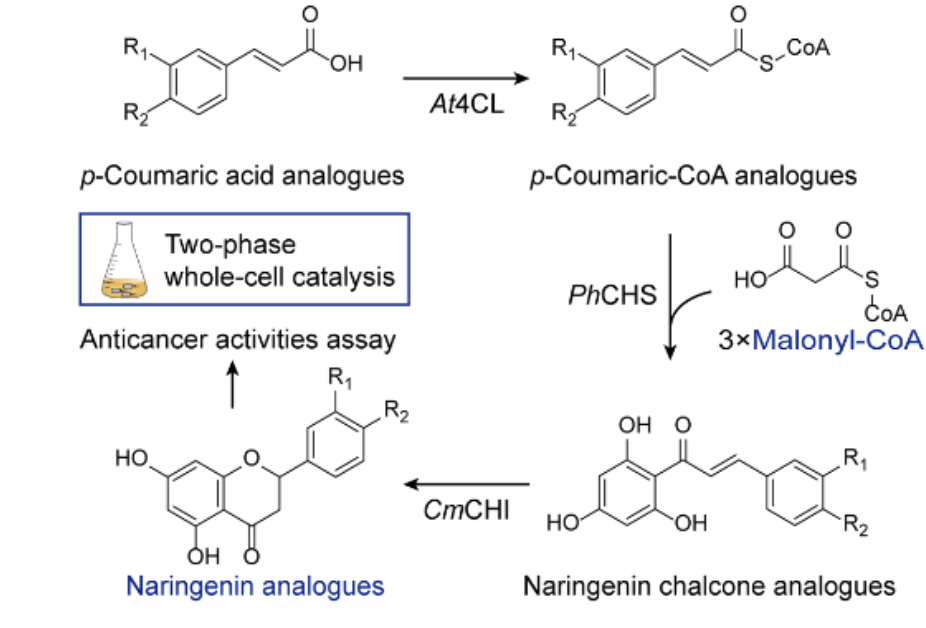

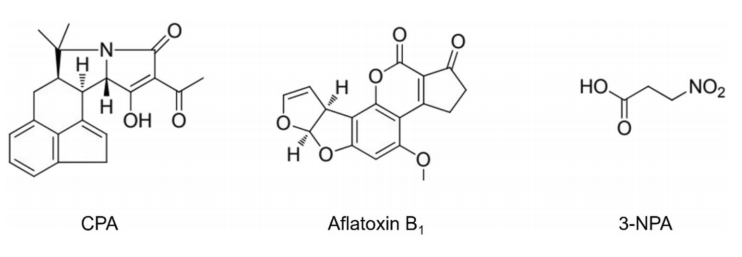




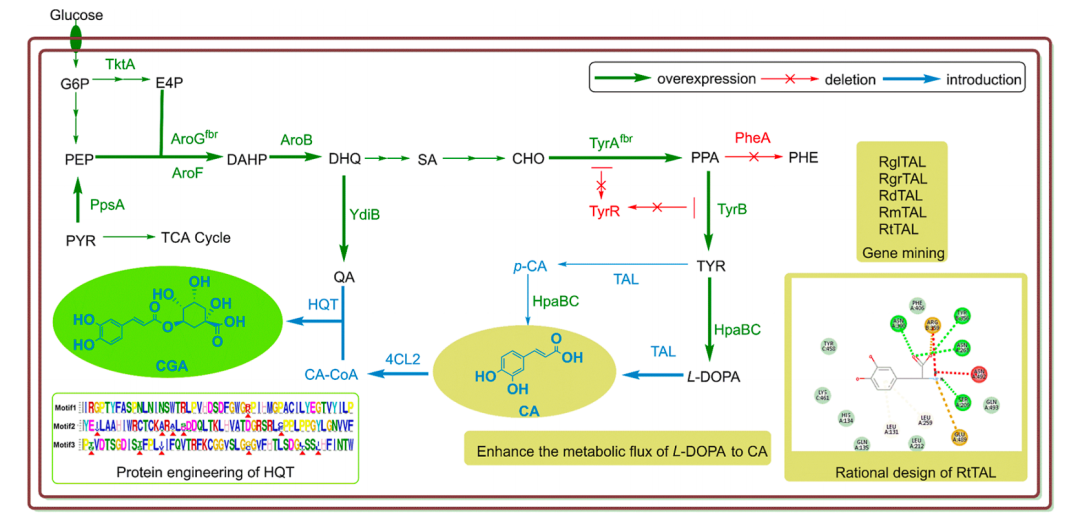
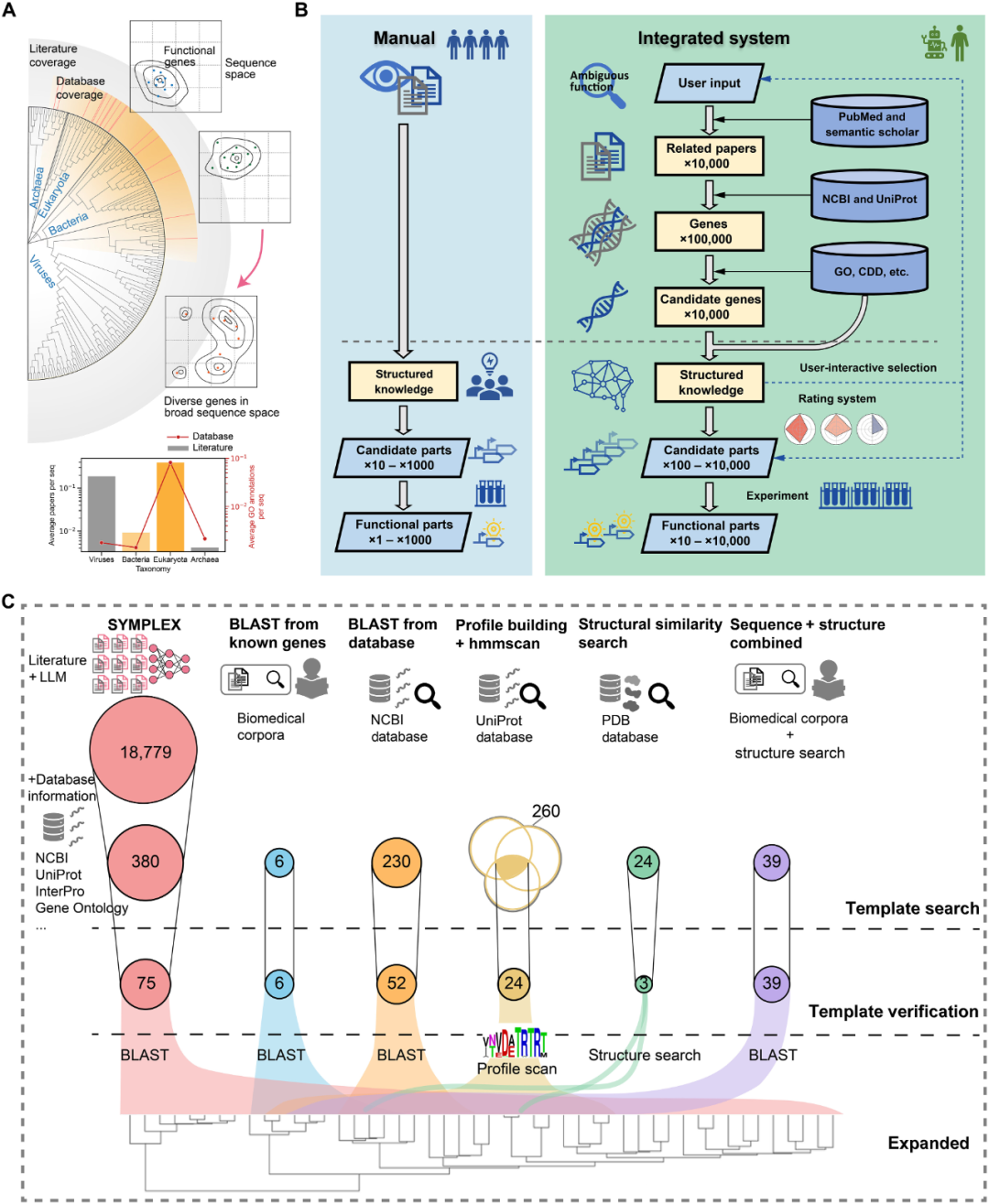
















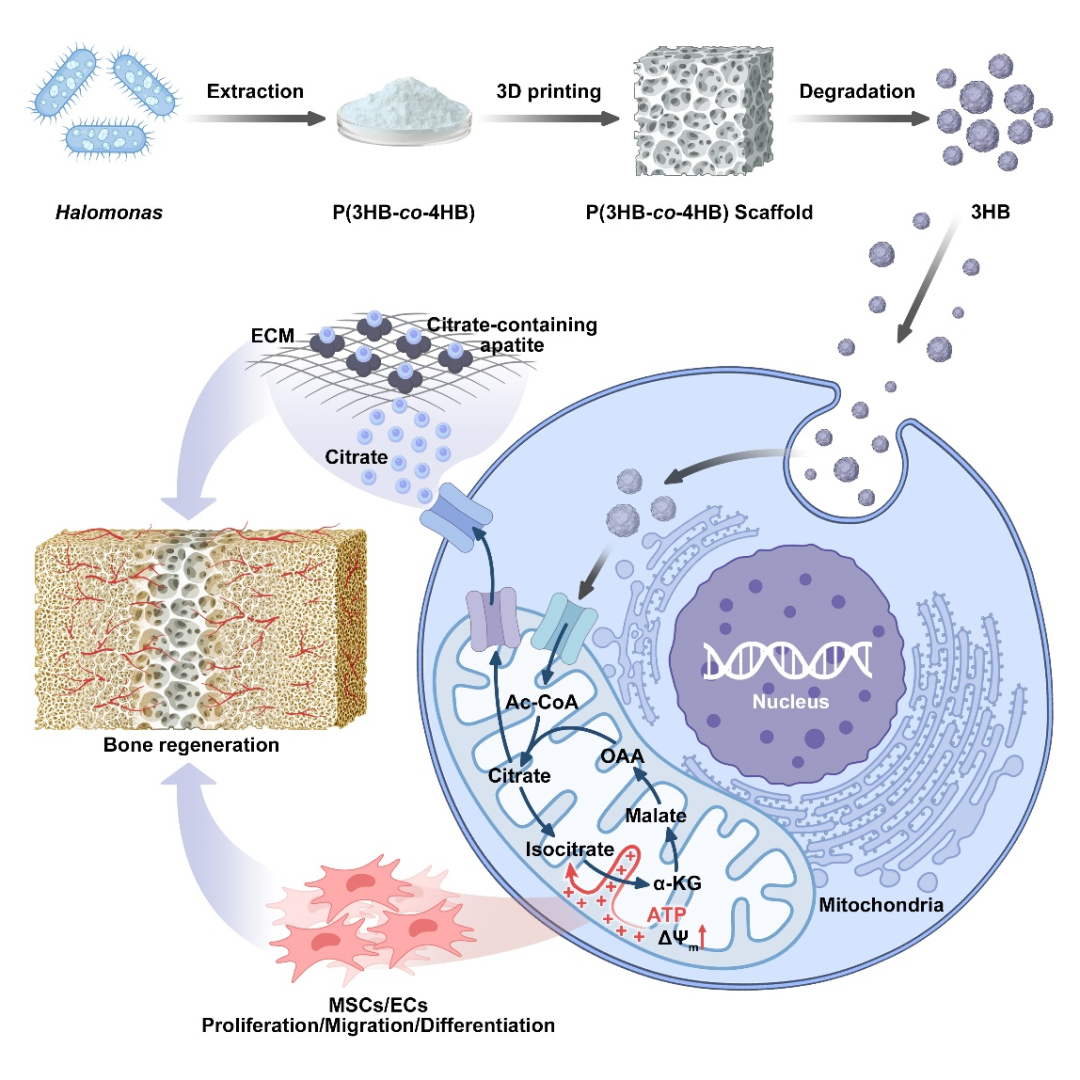
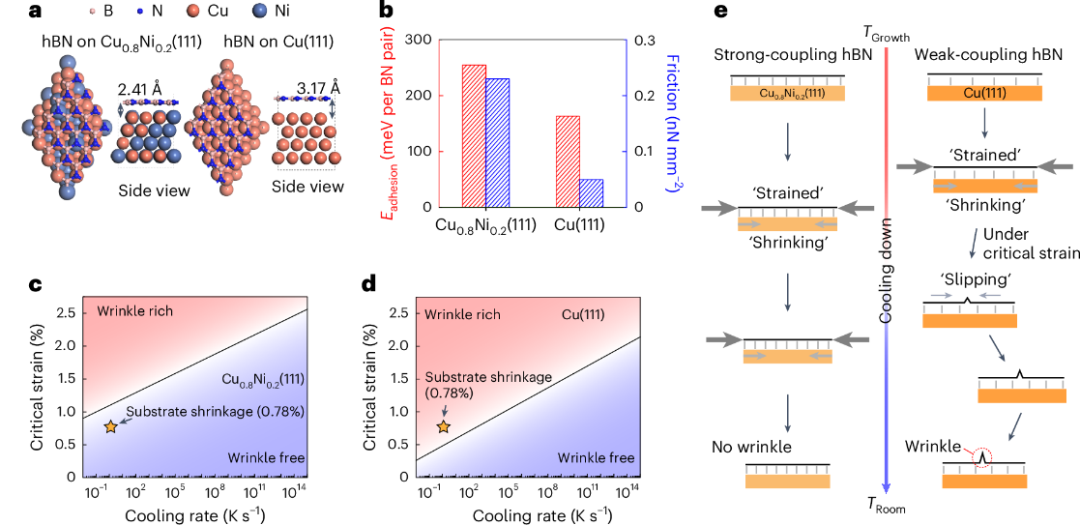








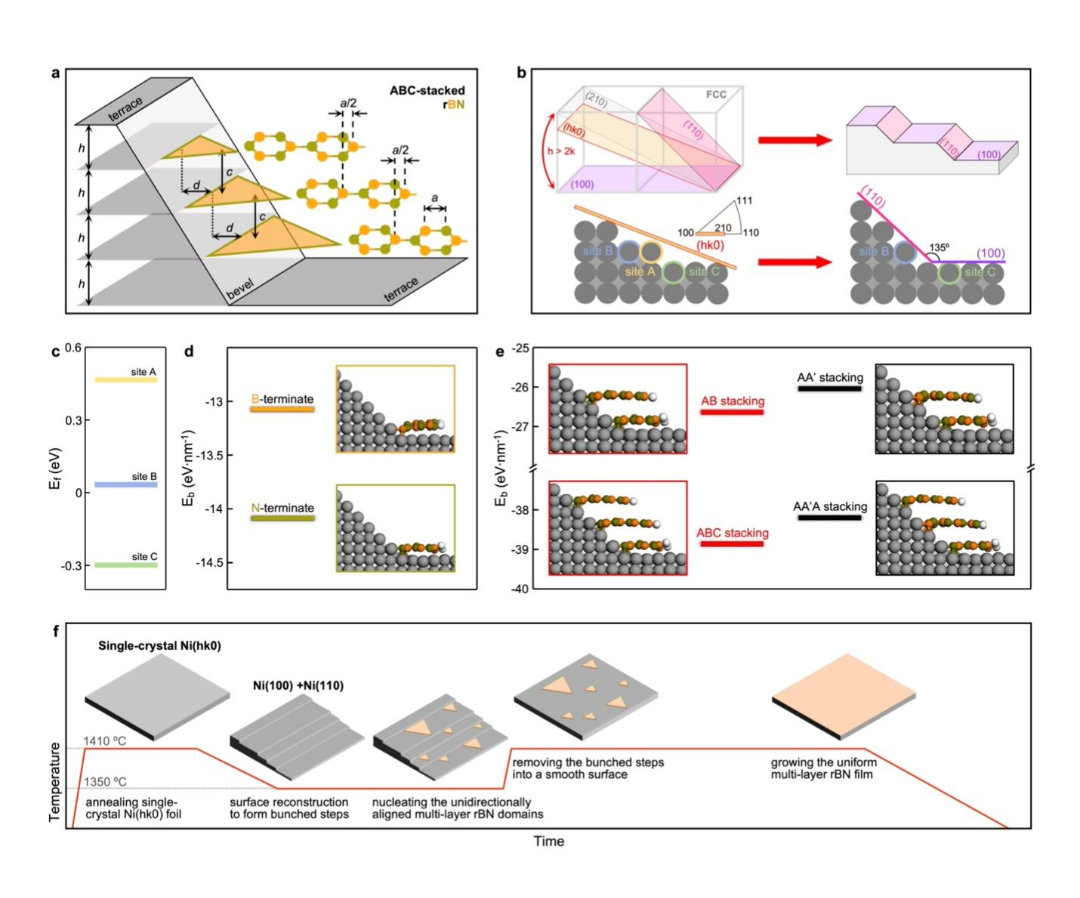

























安各洛(深圳)生物科技有限公司 版权所有