
细菌是生命演化的原初形式也是人类生存环境的重要组成部分细菌为何会演化成超级细菌我们有办法应对超级细菌感染吗央视纪录片频道联合我国多个顶尖实验室推出纪录片《生命如何影响生命》纪录科学家在生命健康领域的突出成就借助生命科学的力量越来越多的疾病有了被治愈的希望本期节目让我们走进中国科学院深圳先进技术研究院听听科研人员怎么说iSynBio造物超级细菌,源于人类自身超级细菌并非天生“超级”,它们是在人类广泛
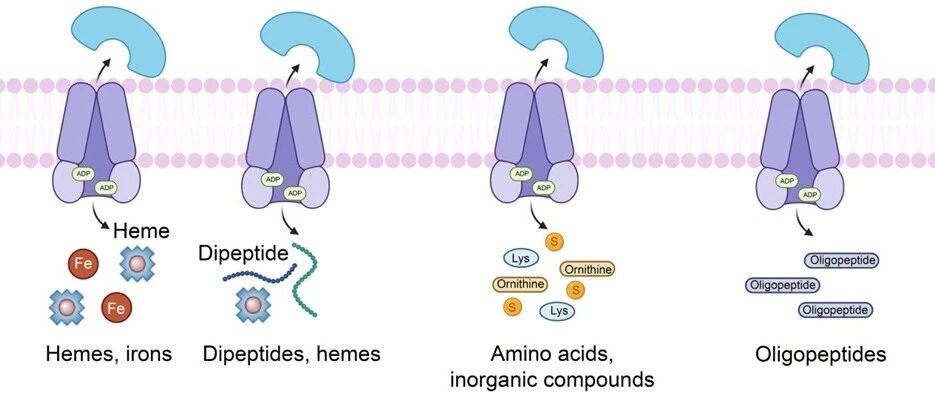
自然界中,几乎所有生命都使用同一套“语言”——由 20 种氨基酸组成的遗传字母表。尽管科学家们后续发现了硒代半胱氨酸和吡咯赖氨酸这两种特殊氨基酸,但天然“字母”的数量依然有限,这从根本上约束了蛋白质结构功能的多样性。为了突破这一天然限制,一种名为“遗传密码子扩展技术”(Genetic Code Expansion, GCE)的工具应运而生。通过引入非天然氨基酸(non-canonical amin
两种简单分子——半胱氨酸和硫酯的反应,或许揭示了生命最初的组成单元是如何被“封装”进细胞膜中。生命的诞生,必然需要一些基本的组成单元。作为遗传物质的DNA和RNA至关重要,它们主导着蛋白质的合成。但还有一类分子,虽然常被常被公众忽视,却同样是生命不可或缺的基石,那就是脂质。地球上几乎所有的生命体都依赖细胞膜。细胞膜由磷脂(属于脂质中的类脂)、蛋白质和糖类等组成,不仅将细胞内部与外部环境分隔开,还负

现在的mRNA技术经常被用于疫苗开发,不过万事皆有例外,mRNA的潜力不止于此。最近一组澳大利亚的研究团队认为,或许mRNA转染能从底层设计上改变抗体的生产工艺。这项研究题为《通过mRNA转染在哺乳动物细胞中快速表达治疗性抗体》,不仅验证了mRNA作为生物制药生产平台的可行性,还展示了其相较于传统方法的具体优劣。传统方法目前大多数抗体药物都是在中国仓鼠卵巢细胞(CHO细胞)中生产的。这类哺乳动物细

新观点——PD-1 阻断并非单纯 “解除免疫抑制、增强抗肿瘤效应”,还可通过破坏 TDLN(tumour-draining lymph nodes) 中高亲和力干细胞样 CD8+T祖细胞(Stem-like progenitor CD8+T,TSL,核心亚型为 TCF-1+PD-1+SLAMF6high)的维持机制,呈现 “短期获益与长期风险” 的矛盾。(Inhibitory

2025年12月1日,Generate:Biomedicines宣布,其AI工程设计的长效抗TSLP抗体GB-0895启动两项三期临床研究SOLAIRIA-1和SOLAIRIA-2,以评估GB-0895治疗严重哮喘的成人和青少年患者。根据新闻稿,这是全球首批推进3期临床阶段的长效抗TSLP抗体。值得注意的是,GB-0895仅用时4年就推进到全球3期——体现了AI制药的强大潜力,包括药物研发的速度、

Imugene Limited一项关于同种异体CD19 CAR-T的临床研究成果入选2025年美国血液学会(ASH 2025)年会摘要。该研究展示了:同种异体CAR-T细胞Azer-cel联用低剂量IL-2,具有更优的临床活性;同时显示出持久性的早期证据、稳健的CAR-T细胞扩增和可管理的安全性。Azer-celAzercabtagene Zapreleucel(Azer-cel,PBCAR019

随着各大药企的下场,各类in vivo CAR-T/NK/M项目的立项,in vivo被视为最有前景的下一代细胞与基因治疗开发策略。而在in vivo CAR细胞之外,以来恩生物、香雪生命科学为首的公司,率先探索将in vivo开发策略用于TCR-T,站在了国际创新的前沿。in vivo TCR-T与CAR-T一样,TCR-T同样作为一种过继性细胞治疗,不同点在于CAR-T细胞表达CAR,而TCR
安各洛(深圳)生物科技有限公司 版权所有